我所科学家首次解析叶酸转运蛋白结构与转运机制
近日,Nature 在线发表了我所张鹏课题组题为“Crystal structure of a folate energy-coupling factor transporter from Lactobacillus brevis”的最新研究进展,报道了来源于乳酸杆菌的能量耦合因子型(Energy Coupling Factor,ECF)叶酸转运蛋白面向内(inward-facing)的晶体结构,揭示了ECF转运蛋白跨膜转运底物的分子机制。
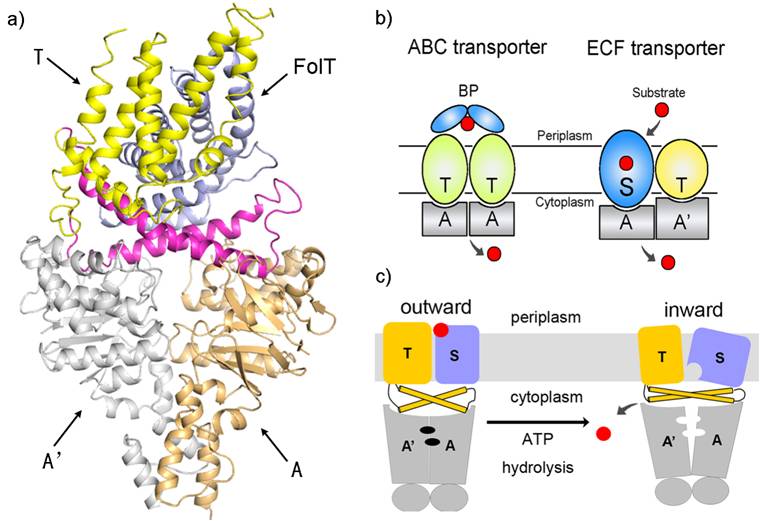
ECF转运蛋白复合体属于新的ABC(ATP Binding Cassette)转运蛋白家族,广泛存在于包含很多致病菌的革兰氏阳性细菌中,负责跨膜转运多种维生素和微量元素。该复合体由细胞膜上底物结合蛋白EcfS、和由膜结合蛋白EcfT、胞内ATP结合蛋白EcfA/EcfA’组成的能量耦合模块构成。其三维结构和跨膜转运的分子机理一直都不清楚。张鹏领导的研究团队通过异源表达纯化的方法获得了具有体内/体外叶酸转运活性的ECF转运蛋白复合体,进而利用上海同步辐射光源(SSRF)测定了该复合体较高分辨率(3.0?)的晶体结构。这是迄今第一个ECF型ABC转运蛋白复合体的结构,也是叶酸跨膜转运蛋白的首个结构。该结构清楚地展示了叶酸ECF转运蛋白复合体的三维构象(图a):两个跨膜蛋白中底物结合蛋白EcfS斜插在细胞膜内,而EcfT蛋白则形成 “L”型构象,由EcfT上伸出的两个呈“X”型的螺旋躺在细胞内EcfA/EcfA’蛋白表面的凹槽中,负责将ATP分解产生的EcfA/EcfA’的构象改变传递到EcfS蛋白。这一结构的解析为人们开展以ECF转运蛋白为靶标的抗生素的药物设计提供了分子基础。
研究人员将结构分析、转运活性实验以及与经典ABC转运蛋白的比较相结合,提出了叶酸通过ECF转运蛋白跨膜转运的模型。在之前对ABC转运蛋白的研究中,人们普遍认为膜结合蛋白二聚体在接受胞外底物时采取“∨”型构象,而释放底物到细胞内时采取“∧”型构象。而在ECF转运蛋白中,底物的转运可通过EcfS蛋白在膜内的构象扭转来实现(图b、c)。这一突破性研究进展使人们对ABC转运蛋白跨膜转运的机理有了全新的认识,同时为人们理解维生素(特别是叶酸)如何实现跨细胞膜转运的过程迈出了一大步。(同一期Nature上报道了清华大学施一公教授研究组的另一ECF转运蛋白的结构,得出了与我们相似的结论。)
张鹏课题组的博士生许可、赵琴、助理研究员张敏华和生化细胞所丁建平课题组的助理研究员俞芳作为文章的共同第一作者。该研究得到了国家科技部、上海市、中科院和依托单位的资助。