张鹏研究组解析泛酸跨膜转运蛋白的结构和分子机理
2014年12月15日,PNAS 在线发表了我所张鹏研究组题为“Structure of a pantothenate transporter and implications for ECF module sharing and energy coupling of group II ECF transporters”的研究论文。该研究报道了跨膜转运泛酸的能量耦合因子型(ECF, Energy Coupling Factor)转运蛋白的三维结构,揭示了group II ECF转运蛋白多个底物结合蛋白S共享ECF模块的分子机理。
泛酸俗称维生素B5,是生物体中辅酶A合成的前体,是人和动物体维持正常生理功能不可缺少的微量营养素,食物中泛酸的含量丰富。ECF类转运蛋白复合体的功能为跨细胞膜转运包括泛酸、叶酸在内的多种B族维生素和微量元素,存在于多种生物体中。该复合体由细胞膜上底物结合蛋白S、和由膜结合蛋白T、胞内ATP结合蛋白A/A’组成的负责能量偶联的ECF模块构成。ECF转运蛋白分为ECF模块专用型(group I)和共享型(group II)两类:前者每一种S蛋白均有各自特定的ECF模块;后者几种不同的S蛋白共享一套ECF模块。ECF转运蛋白的三维结构和跨膜转运的分子机理一直都不清楚。在之前的研究工作中,张鹏课题组解析了叶酸ECF转运蛋白复合体面向细胞内构象的晶体结构,使人们清楚地看到了ECF复合体的三维架构和各组分的作用方式(Xu et al; Nature, 2013);并据此提出了ECF转运蛋白的工作模型:即底物转运很可能通过S蛋白在膜内的翻转来实现(Zhang et al; Trends Microbio, 2013)。然而,人们对ECF模块共享、底物转运等过程的分子机制并不了解。
在本项工作中,张敏华博士和博士生鲍志浩等人在张鹏研究员的指导下,通过解析与叶酸ECF转运蛋白同物种来源的泛酸ECF转运蛋白的结构,以及一系列比较分析和功能实验,揭示了泛酸在转运复合体中S蛋白PanT上的结合位点,以及group II ECF转运蛋白多个底物结合蛋白S共享ECF模块的分子机理:S蛋白上存在一个由跨膜螺旋1、2、6(SM1/2/6)组成的疏水面,不同S蛋白通过这一疏水面与同一T蛋白的CH2/3螺旋(Coupling Helix 2/3)相互作用;T蛋白作为一个介导S蛋白与A/A’蛋白相互作用并传递构象改变的“脚手架”蛋白,自身构象在不同复合体中呈现动态变化,从而保证了其与不同S蛋白的结合。这一研究工作使人们对ECF转运蛋白跨膜转运维生素的过程有了更深入的了解。
该研究得到了国家自然科学基金委、科技部、上海市和中科院的资助。感谢上海光源BL17U线站在实验数据收集中的支持与帮助。
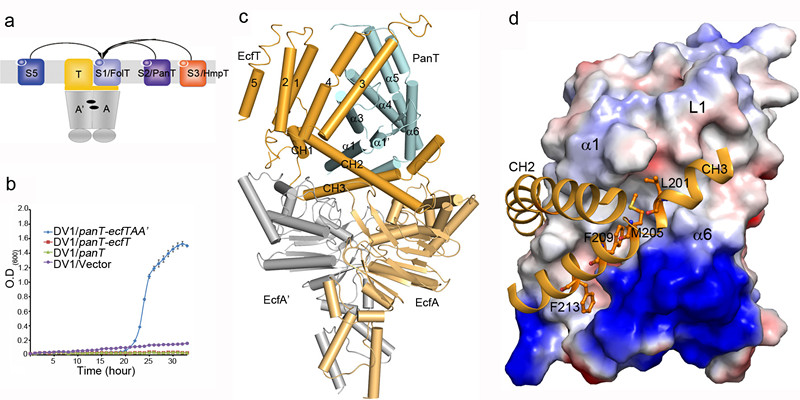
图注:(a)ECF转运蛋白复合体多个底物结合蛋白S共用一套ECF模块(Group II);(b)互补实验证明LbECF-PanT转运泛酸的能力;(c)泛酸ECF转运蛋白LbECF-PanT的晶体结构(四个组分分别是PanT/S、EcfT/T、EcfA/A、EcfA’/A’);(d)不同S蛋白通过SM1/2/6(a1/2/6)组成的疏水面与同一T蛋白的CH2/3相互作用。
