张鹏研究组揭示细菌磷酸化利福平产生耐药性的分子机制
2016年3月21日,美国科学院院刊(PNAS)在线发表了我所张鹏研究组题为“Structural basis of rifampin inactivation by rifampin phosphotransferase”的研究论文。该研究通过解析利福平磷酸转移酶(Rifampin Phosphotransferase, RPH)不同构象的晶体结构,以及生理、生化分析,揭示了RPH磷酸化利福平及利福霉素类抗生素导致其失活的分子机制。
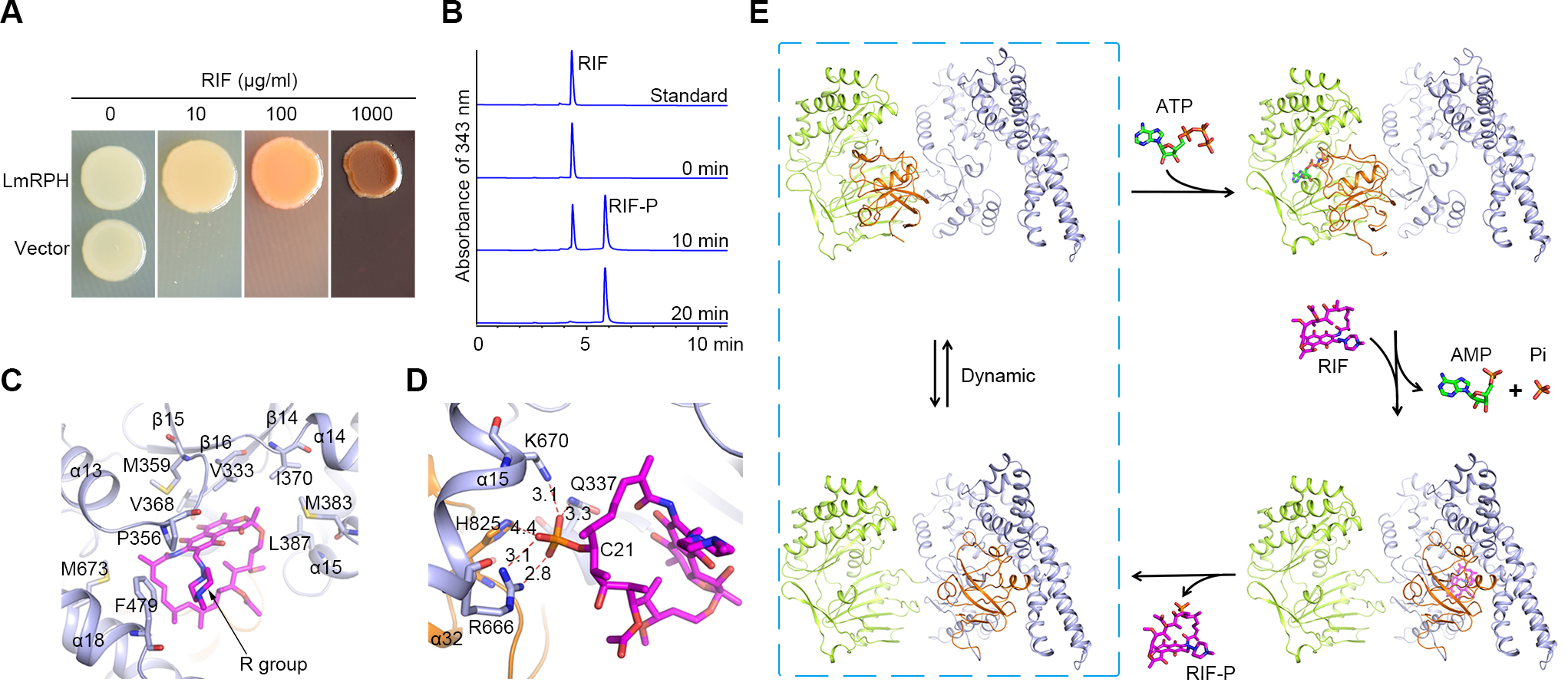
利福平(Rifampin, RIF)属于利福霉素类抗生素,是目前治疗结核病的一线药物,并被广泛应用于其他细菌感染的治疗。长期、大量的使用导致致病菌对RIF产生多种耐药性,严重影响了结核等传染病的防御和治疗,而耐药机理的研究对解决细菌耐药性至关重要。RPH是一类导致细菌对利福霉素类抗生素产生耐受的抗性蛋白,其通过消耗ATP磷酸化利福平及利福霉素(C21位羟基),使其丧失抑菌活性。然而人们对RPH的催化机理却不清楚。
在本项工作中,张鹏研究组的博士研究生齐晓峰等解析了致病菌Listeria monocytogenes来源的利福平磷酸转移酶(LmRPH)催化过程不同底物结合状态的晶体结构。通过结构比较、酶活测定、抑菌实验、质谱分析等实验手段,研究人员发现LmRPH由三个独立的结构域组成:ATP结合结构域(ATP-binding domain, AD)、RIF结合结构域(RIF-binding domain, RD)和一个含有关键催化位点组氨酸的结构域(His-containing domain, HD)。AD上的ATP结合位点和RD上的RIF结合位点相距较远(49?),HD可以在AD和RD之间摆动从而实现磷酸基团从ATP到RIF的传递。HD在此过程中稳定了AD对ATP的结合,并与RD共同形成RIF结合口袋。RIF的主要分子构架(安莎桥和萘酚环)通过疏水作用结合在LmRPH分子表面的结合口袋内,而其R基团游离在口袋外,这一发现解释了为什么RPH对利福霉素家族其他成员同样具有活性。RIF磷酸化位点附近的四个氨基酸His825, Arg666, Lys670和Gln337在催化过程发挥重要作用,其中来自HD的His825在ATP的存在下可被磷酸化,很可能在催化过程中负责磷酸基团的转移。基于上述结果,研究人员提出了RPH催化利福霉素磷酸化的分子机理,而这一磷酸化很可能导致利福霉素对其靶点蛋白(细菌RNA聚合酶)的结合力降低从而丧失抑菌活性。该研究为新一代利福霉素类抗生素的研发指出了方向。
该研究得到了基金委、科技部和科学院的经费资助。晶体衍射数据收集工作得到了国家蛋白质中心(上海)设施19U线站和上海光源17U线站的支持与帮助。
原文链接: http://www.pnas.org/content/early/2016/03/18/1523614113.full