肖友利研究组利用体外酶学研究揭示核苷类抗生素多碳糖双环骨架的生物合成机制
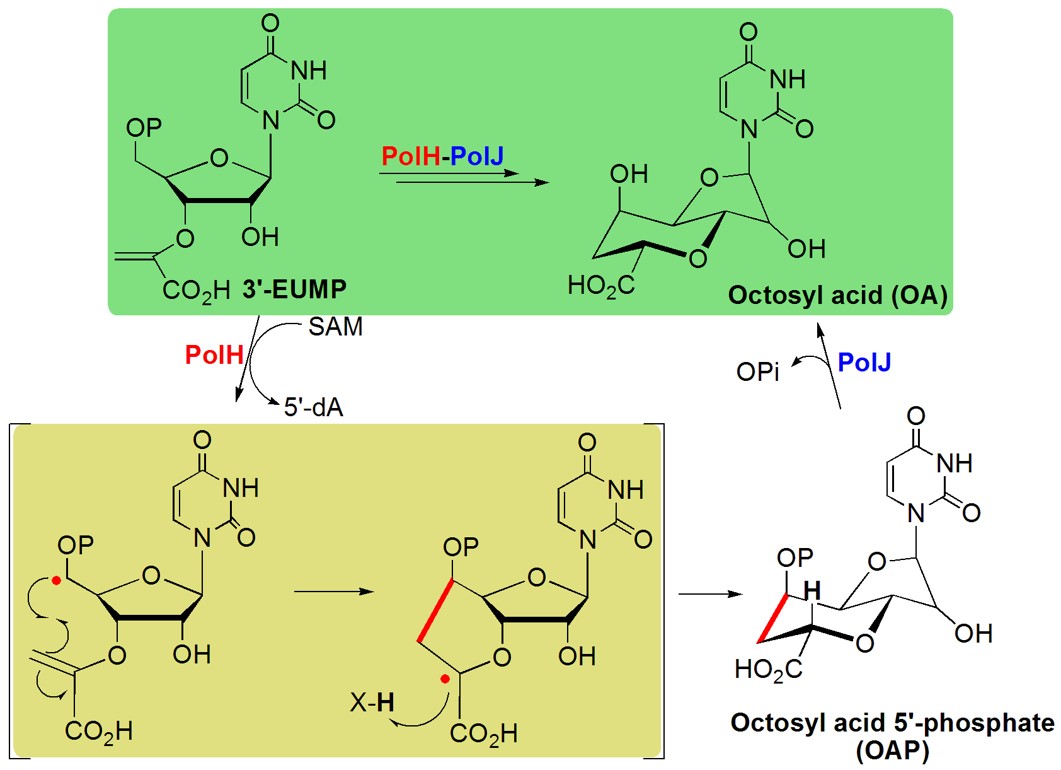
9月5日,英国皇家化学学会化学科学期刊(Chemical Science)在线发表了我所肖友利研究组题为“Construction of the octosyl acid backbone catalyzed by a radical S-adenosylmethionine enzyme and a phosphatase in the biosynthesis of high-carbon sugar nucleoside antibiotics”的研究论文。该工作揭示了重要绿色生物农药多氧霉素生物合成中具有独特八碳糖双环结构的关键中间代谢产物庚糖酸(OA)的分子形成机制。
含有200多种结构迥异的核苷类抗生素具有丰富多样的生物活性,并作为药物广泛应用于抗菌、抗病毒和抗癌等方面。这一家族的天然产物通常以核苷分子母核作为起始代谢物,通过一连串的代谢反应生化修饰,形成复杂多样的结构。在上世纪70年代,针对富产这一家族抗生素放线菌的遗传代谢研究中发现具有独特双环多碳糖的核苷类抗生素,并推测其可能作为关键中间体代谢物参与多个核苷类抗生素的生物合成。虽然相关的合成基因簇测序工作已经完成,但是对于其生物合成形成的分子机制一直没有生化基础上的解释,关键的功能蛋白酶也不清晰。而通过传统遗传代谢方面的研究也并不能解析必需蛋白参与生物合成的功能。
针对这些问题,肖友利研究组博士生贺妮莎等人,与武汉大学邓子新院士团队从事多氧霉素抗生素遗传代谢研究的陈文青课题组、上海有机所的唐功利研究员合作,根据必需蛋白酶的生信预测功能,结合代谢物之间转化的化学和酶学方面的要求,首先通过体外双酶的混合体系实现了推测底物3’EUMP到OA(P)的转化。进一步的分步细致解析,鉴定了该生物转化中双酶各自的功能,并提出了相应两步催化的分子形成机制。值得一提的是,其中负责关键成环的是一类S-腺苷甲硫氨酸(SAM)自由基蛋白酶PolH,尽管这类SAM-依赖的自由基蛋白超家族的成员数已多达近五万个,且其数量还在不断增加,但人们对该类蛋白参与催化独特酶促反应机制认识仍非常有限,因此PolH酶学功能的阐明对理解该类蛋白所催化的新颖自由基机制的碳碳键形成的反应迈出了重要一步。
该研究得到国家自然基金委、生命有机国家重点实验室和上海市科委等经费的资助。分子质谱和蛋白质的顺磁共振波谱测试工作分别得到了中科院上海生科院植生生态所公共技术服务中心代谢组学与蛋白互作技术平台和中科院合肥强磁场科学中心的支持与帮助。
论文链接:http://pubs.rsc.org/en/content/articlelanding/2016/sc/c6sc01826b#!divAbstract