张鹏研究组等合作解析钴离子ECF转运蛋白复合体的结构与机理
ABC转运蛋白依靠分解ATP产生的能量驱动信号分子、营养物质、药物分子等的跨细胞膜转运,是生物体中最大的初级主动转运蛋白家族。ECF转运蛋白是近年来发现的一类新型ABC内向转运蛋白,结构上由膜内底物特异结合蛋白EcfS和一个由跨膜蛋白EcfT和两个胞内ATP结合蛋白组成的能量耦合模块(或ECF模块)组成,分为能量耦合模块专用型(Group-I)和共享型(Group-II)两类(图1a)。专用型每个EcfS蛋白使用专一的ECF模块,共享型多个不同的EcfS蛋白共享同一个ECF模块。ECF转运蛋白在细菌与植物中保守存在,介导微量营养物质的跨膜转运。在前期工作中,张鹏课题组解析了多个共享型ECF转运蛋白复合体的结构,阐释了底物识别、模块共享、跨膜转运的分子机制。然而,人们对专用型ECF转运蛋白的结构与机理缺乏了解。
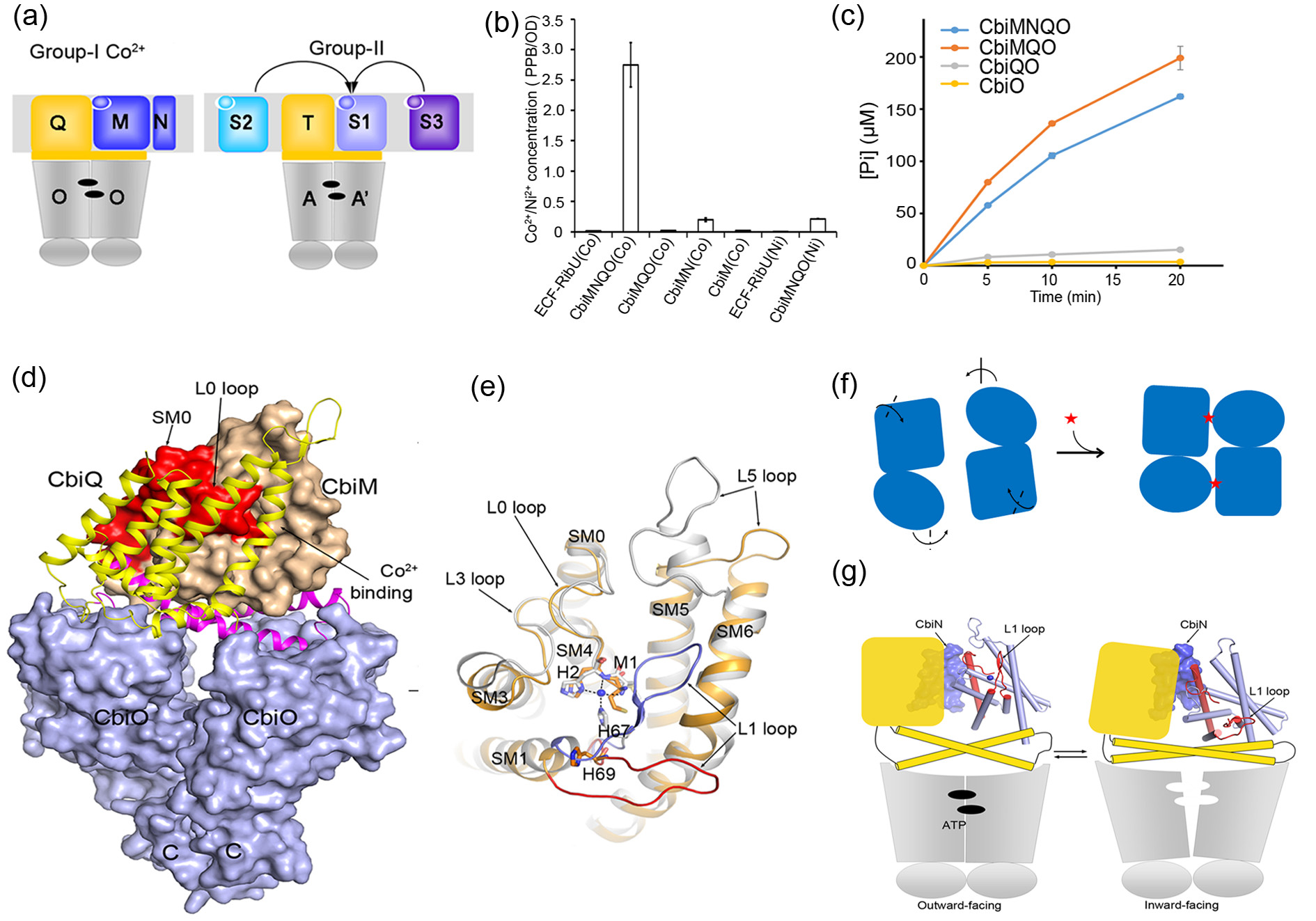
本项工作选择专用型ECF转运蛋白的典型代表—跨膜转运钴离子的CbiMNQO为研究对象开展结构与机理的研究。CbiMNQO是由膜蛋白CbiM、CbiN、CbiQ和细胞质内的ATP结合蛋白CbiO组成的五亚基复合体(图 1a)。研究人员建立了基于质谱的体内转运活性检测系统,发现CbiMNQO的Co2+转运活性需要N蛋白(图 1b)。在体外,N蛋白对复合体的ATP水解活性却没有影响,CbiM蛋白对复合体ATP水解活力则具有强的激活效应,且激活不依赖于底物Co2+的存在(图 1c)。研究人员解析了CbiMQO复合体2.8?分辨率的晶体结构(图 1d)。通过将CbiMQO复合体中底物释放状态的CbiM与之前报道的底物结合状态的NikM进行比较,发现连接第2和第3个跨膜螺旋的L1 loop发生了显著的构象变化(图 1e),可以作为底物进出CbiM的门控开关。进而,通过解析复合体中CbiO蛋白处于ATP结合状态(关闭构象)的结构,并将之与CbiMQO复合体结构中处于ATP释放状态的CbiO结构(开放构象)进行比较,揭示了转运复合体中CbiO蛋白在ATP结合与释放过程中的构象变化(图 1f)。鉴于缺少CbiN不影响复合体的ATP水解活力,但却丧失Co2+转运活性的实验结果,研究人员预测CbiN蛋白在CbiM与CbiQ的构象耦联中起重要作用(图 1g)。这是首次对专用型ECF转运蛋白复合体结构的报道,对理解不同类型ECF转运蛋白的跨膜转运机理具有重要意义。
上述研究成果于2017年3月21日在线发表在Cell Res上,我所张鹏研究组博士研究生鲍志浩和齐晓峰为该论文的共同第一作者,张鹏研究员和清华大学王佳伟教授为论文的共同通讯作者。研究工作得到了我所晁代印研究员研究组和生化细胞所李典范研究员研究组的大力帮助。晶体衍射数据收集工作得到了国家蛋白质中心19U1/18U1线站和上海光源17U线站的支持。感谢国家科技部、基金委和中科院的经费资助。
原文链接:http://www.nature.com/cr/journal/vaop/ncurrent/full/cr201738a.html