王勇研究组在二萜糖苷甜茶素的生物合成途径研究中取得进展
2018年6月6日,国际学术期刊《Molecular Plant》在线发表了中科院分子植物科学卓越创新中心/植物生理生态研究所王勇研究组题为“Diterpenoid UDP-glycosyltransferases from Chinese Sweet Tea and Ashitaba Complete the Biosynthesis of Rubusoside”的研究论文。该研究首次解析了甜茶素(rubusoside)的生物合成过程,报道了甜叶悬钩子(R.suavissimus)与明日叶(A.keiskei)中挖掘得到6条新的二萜糖基转移酶,并对其底物识别的机制进行了研究。
二萜类化合物是一类重要的植物源次生代谢产物,具有广泛的生理和药用活性。尽管二萜类化合物具有广泛的分布,但其糖基化修饰却非常罕见,自然界仅有极少数植物,如甜叶菊(S. rebaudiana)、甜叶悬钩子 (R. suavissimus)与明日叶(A. keiskei)等能生产糖基化的二萜类化合物。这些二萜糖苷在食品工业、药物开发中具有巨大的开发和应用前景。甜茶素(Rubusoside)即是其中的代表,它是一种稀有的糖基化贝壳杉烯型四环二萜类分子,主要来源于两种药食同源的植物—甜叶悬钩子和明日叶。其甜度约为蔗糖的60倍而热量仅仅为蔗糖的1/10,是一种理想的天然甜味剂。新近的报道表明,甜茶素是首个发现的可同时抑制人果糖转运蛋白GLUT5和葡萄糖转运蛋白GLUT1的小分子化合物,具有独特的药理活性。
为了解析甜茶素的合成途径,本文在前期甜菊糖苷的工作基础上,进一步对甜叶悬钩子和明日叶的叶组织样本进行了转录组分析,通过物种间进化分析、结合基因克隆表达与功能表征,找出了甜茶素生物合成过程中的糖基化途径的关键酶基因,结果发现甜叶悬钩子来源的UGT75L20、UGT75T4、UGT85A57和明日叶来源的UGT75L21、UGT75W2、UGT85A58参与了这一过程。在对甜叶悬钩子来源的UGT85A57的深入研究中进一步发现,UGT85A57具有高度的底物专一性,仅催化19位具有糖基的steviol衍生物。为了研究糖基转移酶如何专一性的识别底物,作者通过同源建模分析,对UGT85A57中可能影响二萜底物识别的20个N端和5个C端氨基酸残基进行了定点突变,发现L141M、S149G和L153F三个位点的突变使得UGT85A57的底物专一性降低,表明它们在二萜底物的专一性识别方面起到重要作用。最终,作者通过不同物种来源的糖基转移酶的正交组合,在微生物细胞中实现了甜茶素的高效全细胞转化。本研究首次阐明了甜茶素的合成过程,也为通过合成生物技术实现甜茶素类稀有二萜糖苷的大规模工业生产奠定了基础。该研究结果丰富了我们对四环二萜类化合物的糖基化修饰的认识,对二萜化合物的糖基转移酶的底物专一性识别机制提供了有助的见解。为我们今后利用和改造这类修饰酶,获得更多的非天然二萜类糖基化产物,改善二萜类化合物的结构和功能多样性提供了基础。目前,这一成果已与浙江震元制药有限公司签署了基于合成生物技术的甜茶素产业化开发协议。
王勇研究员带领的天然产物合成生物学研究组长期从事天然产物的合成生物学研究。研究内容涉及各种与天然产物合成相关的基因、模块、途径和宿主等资源的分离、鉴定;天然产物的合成生物学设计与异源合成等。基于合成生物学人工设计的原理,获得天然的或非天然的复杂次生代谢产物是该组研究的核心内容。
天然产物合成生物学研究组博士后孙雨伟、博士生陈卓为本文的第一和第二作者,王勇研究员为本文的通讯作者。中科院分子植物科学卓越创新中心/植物生理生态研究所植物分子遗传国家重点实验室张鹏研究员、李建戌副研究员、上海海洋大学食品科学与工程学院杨靖亚副教授等也为本研究作出了贡献。本研究得到了国家自然科学基金、上海市科委重点基础研究项目、中科院重点研究项目、先导B类和植物分子遗传国家重点实验室的资助。
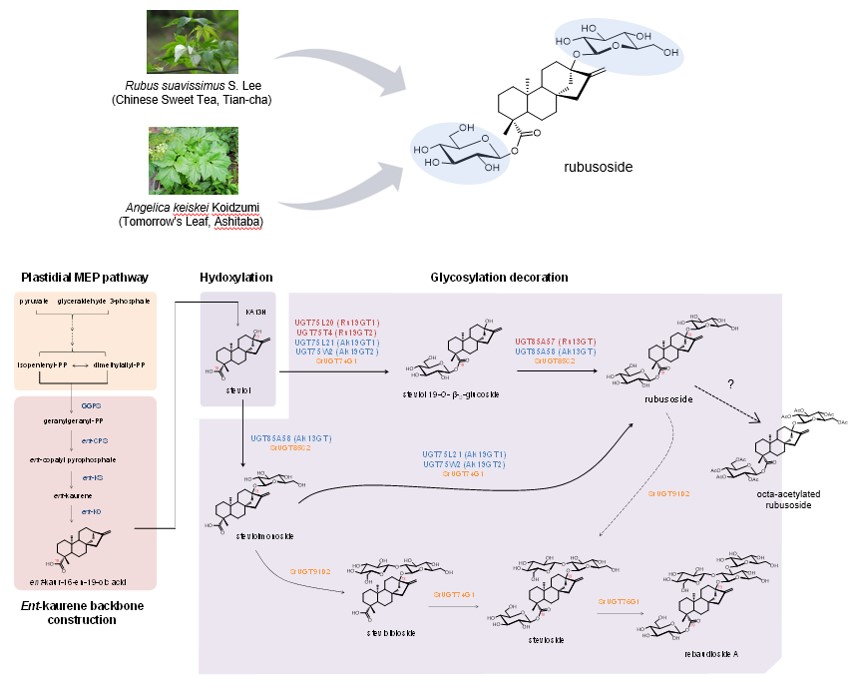
图1 甜茶素生物合成的糖基化修饰
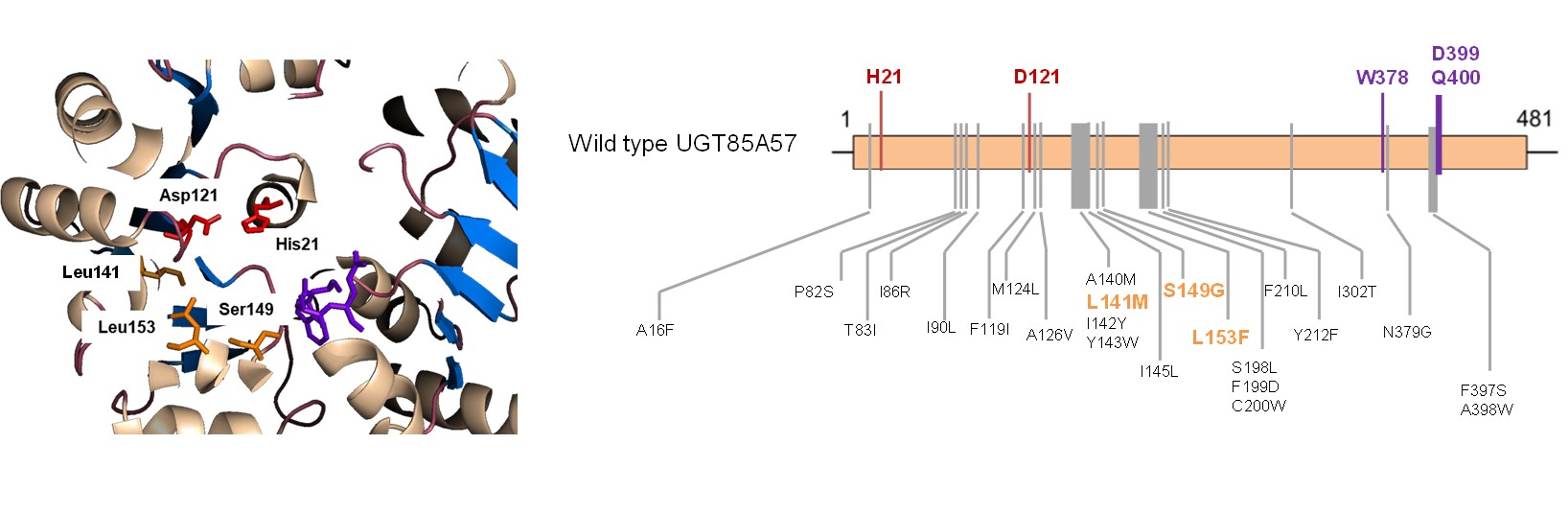
图2 RsUGT85A57中对于底物识别起关键作用的氨基酸位点