肖友利研究组与周志华研究组等合作实现氮-甲基吡咯啉的微生物合成
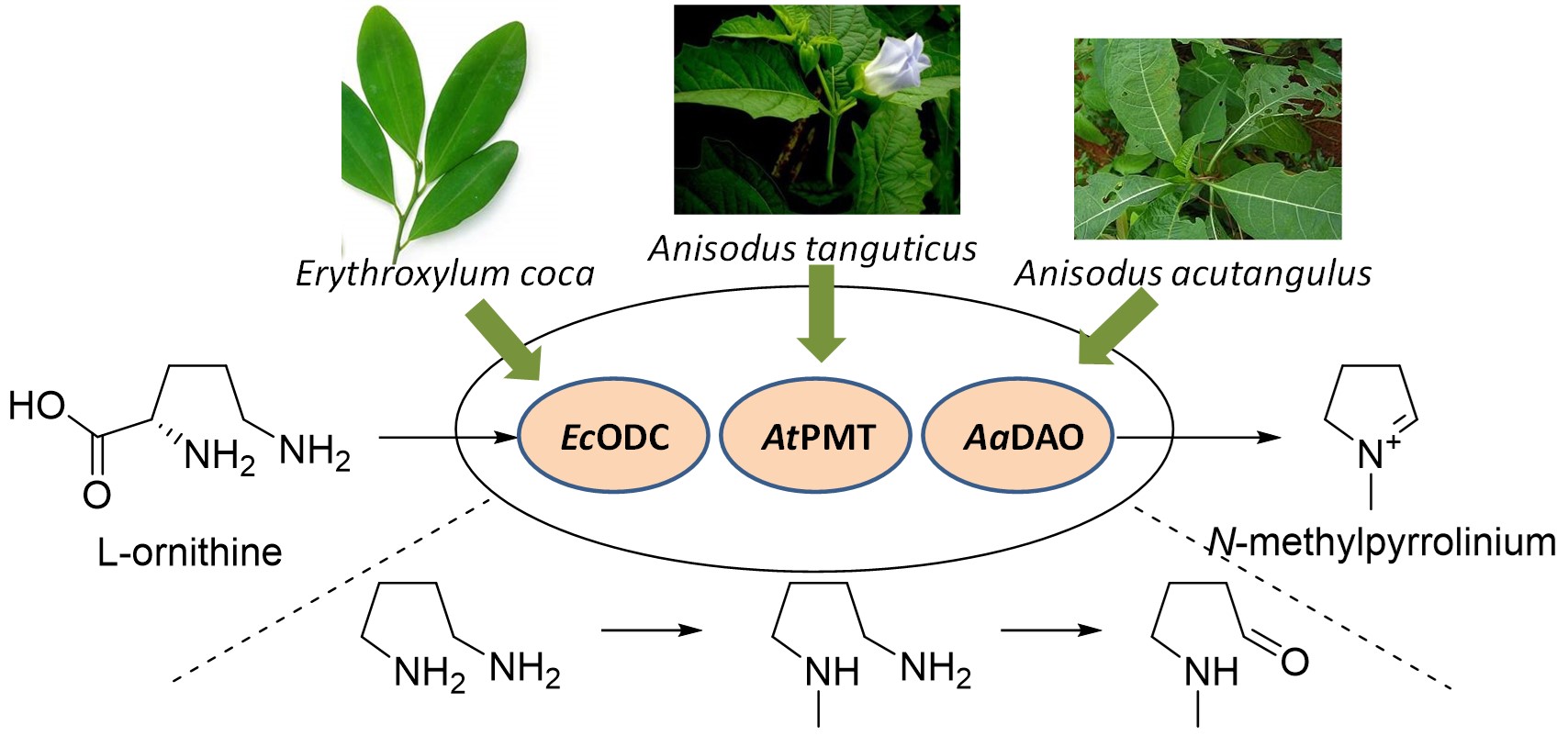
以N-甲基吡咯啉为生物合成关键共同中间体的(降)托品生物碱如(东、山)莨菪碱、打碗花精等具有重要的生物活性及临床药用价值。这些生物碱目前主要是通过本源植物的传统提取方法获得,而基于合成生物学的微生物异源合成技术为药用天然产物的制备提供了新策略。N-甲基吡咯啉的生物合成以L-鸟氨酸为前体,经过鸟氨酸脱羧酶催化得到腐胺,腐胺进一步被胺氧化酶氧化脱氨形成N-甲氨基丁醛,随后经过希夫碱式自发反应生成N-甲基吡咯啉。为了构建异源合成N-甲基吡咯啉的底盘细胞,肖友利研究组的平羽同学和周志华研究组的李晓东同学等研究人员1)首先解析了药用植物来源三分三的胺氧化酶AaDAO2及AaDAO3的生化功能,并耦联古柯来源鸟氨酸脱羧酶EcODC及山莨菪来源的腐胺-N-甲基转移酶进行体外酶催化一锅法合成,筛选出由EcODC, AtPMT 及AaDAO3组成的体外合成N-甲基吡咯啉的最优催化模块;2)进一步将此模块中的三个结构基因导入大肠杆菌及酿酒酵母中构建相应的底盘细胞并进行摇瓶发酵测试,成功获得目标化合物N-甲基吡咯啉的产量分别为3.02 及2.07 mg/L的大肠杆菌和酿酒酵母底盘细胞;3)在此基础上,为进一步提高产量,该研究还敲除了酵母底盘细胞中N-甲基吡咯啉的竞争代谢途径相关酶ALD4, ALD5及HFD1, 同时通过过表达SAM2加强了合成途径关键酶AtPMT催化所需辅因子SAM的合成,最终酵母底盘细胞中N-甲基吡咯啉的产量达到17.82 mg/L,相比原始菌株提高了8.6倍。该研究首次构建了异源合成N-甲基吡咯啉的微生物底盘细胞,为以N-甲基吡咯啉为前体的药用生物碱的未知合成途径的解析及异源合成奠定了重要的基础。
该研究工作也得到浙江中医药大学开国银教授的合作支持以及中国科学院项目经费的资助。代谢物质谱和小分子核磁的测试表征工作得到了中科院分子植物科学卓越创新中心/植物生理生态研究所公共技术服务中心代谢组学与蛋白互作技术平台的支持。