张鹏研究组揭示蓝藻CO2浓缩机制中HCO3-转运蛋白BicA的结构与机理
2019年11月11日, Nature Plants在线发表了中国科学院分子植物科学卓越创新中心张鹏研究组题为 “Structural mechanism of the active bicarbonate transporter from cyanobacteria”的研究论文。该研究解析了蓝藻CO2浓缩机制中SLC26家族HCO3-转运蛋白BicA的三维结构,揭示了其跨膜转运HCO3-的分子机制。
蓝藻在进化中形成了独特的CO2浓缩机制 (CO2 concentration mechanism, CCM),显著提高了光合作用效率。CCM由五种无机碳(HCO3-/CO2)转运蛋白和羧酶体组成。BicA是CCM中的关键蛋白,是一种高通量低亲和力的HCO3-转运蛋白(转运过程需要Na+),在分类上属于Solute Carrier 26 (SLC26)家族转运蛋白。与多数SLC家族转运蛋白不同,SLC26家族转运蛋白不仅包含有跨膜通道结构域,还包含一个膜内侧的STAS结构域。人们对BicA转运蛋白如何实现HCO3-高通量跨膜转运,以及SLC26家族转运蛋白的分子机制不清楚。
在本研究中,研究人员利用晶体学手段解析了BicA蛋白跨膜结构域和膜内侧STAS结构域的三维结构,并且利用冷冻电镜方法获得了BicA全长蛋白低分辨率的三维结构。研究发现BicA是通过STAS结构域形成同源二聚体发挥功能,单独的跨膜结构域不具备跨膜转运活性或生理活性。这一特点很可能存在于所有的SLC26家族转运蛋白中,并且与大多数已知的SLC家族转运蛋白明显不同。鉴于所获得的BicA蛋白跨膜结构域的结构处于底物HCO3-和Na+结合且朝向细胞内的构象状态(inward-facing substrate binding conformation),这使得人们清楚地看到了HCO3-和Na+的结合位点。基于结构的分析揭示了决定HCO3-特异结合的关键氨基酸残基,并通过生理手段得到了验证。最后,通过与已知其他家族(SLC4)HCO3-转运蛋白的结构比较,研究人员提出了SLC26家族转运蛋白跨膜转运的“电梯模型”。值得一提的是,为提高C3植物的光合作用效率,科学家们近年来开始着手将蓝藻CCM机制引入到绿色植物中。BicA作为一种高通量的HCO3-转运蛋白成为首选的靶标,该研究结果为BicA的应用与改造奠定了分子基础。
中国科学院分子植物科学卓越创新中心张鹏研究组已毕业学生王程程博士是本研究工作的第一作者,张鹏研究员为论文的通讯作者。生理功能分析工作与分子植物科学卓越创新中心米华玲研究员研究组、英国利物浦大学刘鲁宁教授研究组合作完成。该研究得到了中国科学院先导B、基金委、上海市及英国皇家学会的资助。实验数据收集工作得到了上海光源19U1/17U1线站、张江实验室蛋白分离制备系统、电镜平台和中国科学技术大学孙林峰教授的支持与帮助。
论文链接:https://www.nature.com/articles/s41477-019-0538-1
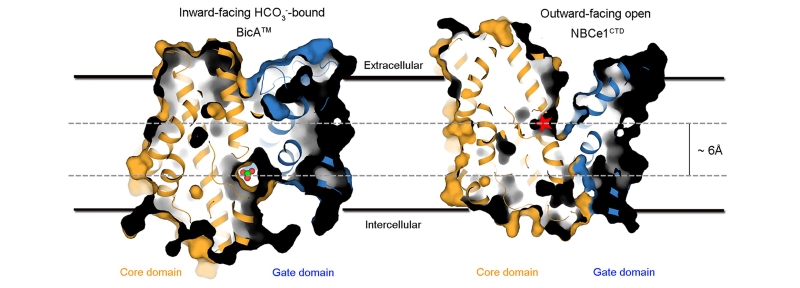
图1. BicA 跨膜转运HCO3-的机制模型。HCO3-的跨膜转运依靠core domain垂直于膜的上下运动(elevator mechanism)实现。