赵杨研究组和朱健康研究组发现渗透胁迫上游信号重要元件
2020年10月8日,中国科学院分子植物科学卓越创新中心上海植物逆境生物学研究中心在Current Biology期刊发表了赵杨研究组和朱健康研究组合作的题为“BONZAI Proteins Control Global Osmotic Stress Responses in Plants”的研究论文。该论文报道了Ca2+响应的磷脂结合蛋白OSMO1/BON1作为上游信号元件介导整体渗透胁迫应答。
干旱、盐胁迫以及低温等非生物逆境导致的渗透胁迫造成作物生产的巨大损失,是危害我国和世界粮食安全的重要因素之一。植物因其固着生长的特性而难以躲避所受到的渗透胁迫,被迫进化出感知和适应逆境的机制,主要包括信号接收与传导、植物激素脱落酸(ABA)相关调控和后期应答等过程。目前ABA途径的信号传导与渗透胁迫后期应答机制已基本解析,然而,对于植物如何感受外界的渗透胁迫信号,以及如何传递信号到细胞内并引起早期应答的分子机制仍不清楚。
渗透胁迫诱导多种应答,包括瞬时产生的Ca2+信号(1s内,持续约2min)、RAF/OK和SnRK2等蛋白激酶的激活(5min内,持续约2h)以及Ca2+信号依赖的胁迫应答,紧接着诱导ABA的积累、气孔关闭和基因表达变化(1h内,持续约几天),进而影响生长调控、叶片衰老以及休眠等过程。近年来,研究发现若干Ca2+通道或转运蛋白例如OSCA1、KEA和cMUC介导渗透诱导的细胞质和质体Ca2+信号,但不能调控整体胁迫应答如SnRK2的激活和ABA的积累等,暗示存在依赖于Ca2+信号和不依赖于Ca2+信号的渗透胁迫应答,或者有不止一类胁迫信号感受器。假设存在一个信号网络控制胁迫的感应和早期信号传导,推测其元件缺失突变体中整体胁迫应答丧失。那么,同时介导依赖于Ca2+信号和不依赖于Ca2+信号的胁迫应答的感受器是否存在?
该研究利用渗透胁迫诱导的Ca2+响应作为切入点,建立了基于Ca2+荧光探针Aequorin的正向遗传筛选系统,用于鉴定上游信号传导的关键组分。基于Aequorin的Ca2+荧光监测有灵敏度过低的缺点,其生物光峰值位于叶绿素b最大吸收波长范围。为了减少拟南芥幼苗中叶绿素的干扰,研究人员巧妙地将Aequorin报告系统引入到具有白化子叶表型的sig6突变体中,得到AEQsig6材料。通过正向遗传筛选,得到渗透诱导的Ca2+信号减弱的突变体osmo1。
OSMO1编码一个Ca2+依赖的磷脂结合蛋白BON1,定位于细胞膜上,其N端受肉豆蔻酰化修饰,并包含两个Ca2+依赖的结合磷脂的C2结构域;其C端含有响应Ca2+的VWA结构域。研究人员发现,BON蛋白不仅调控胁迫介导的Ca2+信号,还介导ABA积累、基因表达变化以及生长调控等多种胁迫应答,表明其属于渗透胁迫上游信号网络中的一个新的信号元件。然而,胁迫介导的SnRK2蛋白激酶的激活在bon123三重突变体中并未丧失,暗示胁迫感受器通过BON蛋白介导Ca2+信号和ABA积累等过程,并通过不依赖于BON蛋白的过程介导SnRK2的激活。
进一步研究发现,渗透胁迫下R蛋白介导的信号被激活,并拮抗ABA积累、基因表达等胁迫应答。之前的报道表明BON蛋白参与生物胁迫响应,是R蛋白介导的免疫应答的负调节因子。遗传证据表明,BON蛋白通过抑制包含SNC1的R蛋白响应,调控除Ca2+信号之外的整体胁迫应答。
综上,该研究发现了BON蛋白是渗透胁迫引起的Ca2+信号和一系列渗透胁迫反应的关键调控因子,并揭示了NLR介导的免疫信号对渗透胁迫应答的抑制,指出了BON蛋白介导生物和非生物胁迫响应的平衡。
赵杨研究组的博士生陈控、助理研究员孙姝璟以及西北农林科技大学草业与草原学院高景慧副教授为该论文共同第一作者。朱健康院士和赵杨研究员为该论文的共同通讯作者。该工作同时得到康奈尔大学华健教授的大力支持。该项研究得到中科院先导项目、国家自然科学基金以及上海市浦江计划的支持。
论文链接:https://www.sciencedirect.com/science/article/pii/S0960982220313476
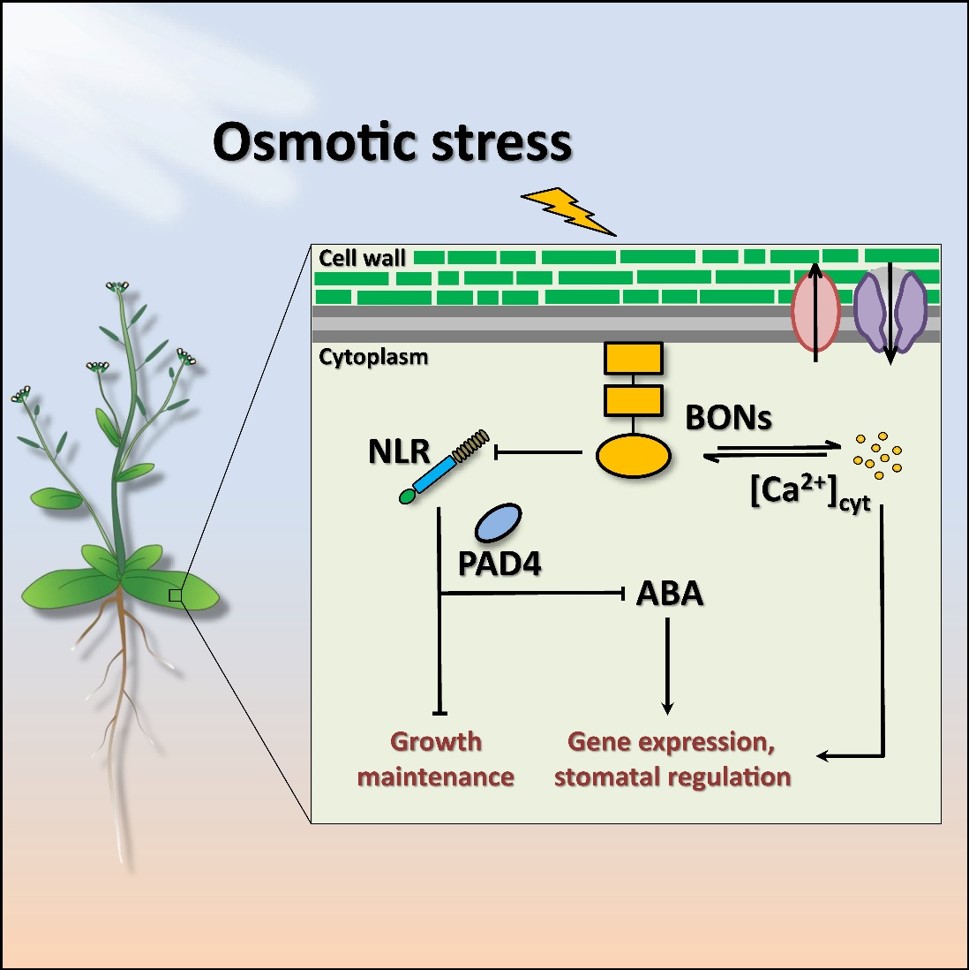
图1:BON蛋白介导整体渗透胁迫应答。渗透胁迫介导细胞壁和质膜的瞬时变化,可能被定位于细胞壁与质膜的受体复合体所感受,从而介导整体胁迫应答。Ca2+依赖的磷脂结合蛋白BON定位于细胞膜,参与调控渗透胁迫介导的Ca2+信号;并通过抑制包含SNC1的R蛋白介导的免疫应答,控制胁迫下ABA积累、气孔关闭、基因表达变化和生长调控等过程。