王鹏程研究组解析ABA信号转导途径关键调控机制
2021年4月28日,中国科学院分子植物科学卓越创新中心王鹏程研究组在Nature Communications期刊发表题为“Initiation and amplification of SnRK2 activation in ABA signaling”的研究论文,揭示了植物激素脱落酸(ABA)信号通路中核心组分SnRK2激活过程中的起始-放大机制。
干旱、高盐、低温等胁迫诱导植物激素ABA含量的增加。ABA促进休眠、减少水分散失、抑制植物生长、诱导胁迫相关基因的表达等,促进植物对胁迫环境的适应,是植物最重要的“抗逆激素”。已知植物特有的蛋白激酶SnRK2是ABA受体偶联核心信号途径(receptor-coupled core signaling)的核心组分。在非胁迫条件下,A组PP2C家族的蛋白磷酸酶结合并去磷酸化SnRK2,阻断ABA信号途径和逆境响应。干旱等胁迫环境诱导ABA的产生或者释放。ABA与受体PYR/PYLs/RCARs蛋白结合形成复合体,结合并抑制PP2C。SnRK2从PP2C抑制的状态中释放出来,活化的SnRK2磷酸化下游转录因子、离子通道等,激活ABA信号通路和胁迫应答过程。在这一过程中,植物体内的SnRK2从无活性的去磷酸化状态转换为激活状态,是植物应答ABA以及环境胁迫过程的核心环节。
2020年初,王鹏程研究组、美国Julian Schroeder研究组,日本Yamaguchi-Shinozaki研究组,几乎同时在Nature Communications发表研究论文,发现B亚组RAF家族蛋白激酶介导了SnRK2的磷酸化和激活过程。在本项研究中,为了研究少量激活的RAF如何快速诱导SnRK2的激活,文章作者利用SnRK2.6 上M94G的这一氨基酸的点突变,扩大SnRK2蛋白激酶的ATP Binding Pocket(ATP结合口袋),同时在体外反应中引入一种苯基修饰的ATP,SnRK2.6 M94G可以利用这种ATP类似物进行激酶自身的硫代磷酸化(Thiophosphorylation)以及对底物的硫代磷酰化,而正常的RAF和SnRK2.6不能利用这种ATP类似物,这样以区分RAF对SnRK2的磷酸化和SnRK2的自磷酸化。借助这一技术发现了RAF磷酸化并激活SnRK2后,被激活的SnRK2.2/3/6通过分子间硫代磷酰化并激活其它尚未活化的SnRK2激酶,迅速地放大ABA信号途径。
同时,王鹏程研究组构建了新的B2和B3亚组RAF的多突变体材料,发现B2和B3亚组RAF蛋白激酶共同参与了ABA信号转导过程。B2和B3亚组RAF多突变体OK100-nonu表现出与snrk2.2/3/6三突变体以及pyl多突变体类似ABA不敏感表型,可以在高浓度ABA处理下萌发和生长。同时OK100-nonu在气孔运动、生长发育、胁迫应答等方面表型出与snrk2.2/3/6三突变体以及pyl多突变体类似。在OK100-nonu突变体中,ABA不能激活SnRK2。因此,B2和B3亚组RAF是ABA信号途径中的核心组分。
这一研究工作对现有的植物ABA受体偶联的信号通路做出了重要修订: ABA-PYL-PP2C负责SnRK2的结合抑制或释放,而RAF通过磷酸化介导SnRK2的自激活启动SnRK2的活化过程。这一起始-放大的激酶激活过程还可能是蛋白激酶偶联途径的普遍机制。
中国科学院分子植物科学卓越创新中心王鹏程研究组的博士研究生蔺祯、王雨蓓,中国农业大学生物学院李媛副教授是本文的共同第一作者。王鹏程为本文的通讯作者。这一工作受到中国科学院和国家自然科学基金委项目的资助。
论文链接:https://www.nature.com/articles/s41467-021-22812-x
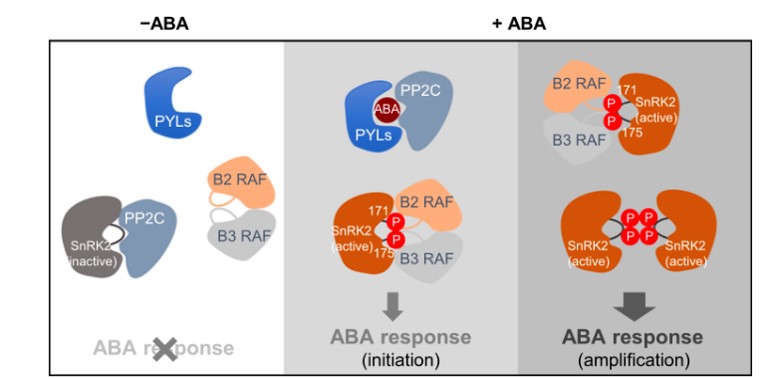
图:RAF通过磷酸化介导SnRK2的自激活启动SnRK2的活化过程