李轩研究组通过分割APOBEC3A双重酶活性实现构建特异性RNA碱基编辑酶
2021年5月2日,国际合成生物学领域期刊ACS Synthetic Biology在线发表了中国科学院分子植物科学卓越创新中心李轩研究组和中科院上海巴斯德研究所郝沛研究组的合作研究成果“Creating RNA Specific C to U Editase from APOBEC3A by Separation of Its Activities on DNA and RNA Substrates”。这项研究基于APOBEC3A和DNA底物的晶体结构,通过半理性设计分割其对DNA和RNA底物的双重催化活性,构建了首个RNA特异性的C>U编辑酶,为RNA精准编辑提供了高效特异性工具。
在DNA编辑方法获得了巨大成功的同时,发展针对RNA的精确编辑技术,具有其独特的技术优势和应用价值。RNA编辑不改变编码基因本身, 在时间、空间和效率上更可控;可以同时靶向多基因和单基因多拷贝的所有转录本,所以更高效。利用RNA定点编辑修复疾病组织的突变基因,对疾病的基因治疗有巨大的应用潜力。
前期工作中,该团队利用无切割活性dCas13a与人源ADAR2(腺苷脱氨酶2)催化域融合,实现了对RNA的A>I碱基精确编辑[Nucleic Acids Res 46:e90 (2018)]。该团队还利用RNA编辑策略,首次实现了对逆转录病毒/转座子复制转移的编辑干预[Cell Discovery 6:30 (2020)]。对于尚待完善的RNA编辑系统,美国MIT张锋教授利用对ADAR2多重突变实现了C>U的RNA编辑[Science 365:382(2019)],但其存在主要问题是ADAR2突变酶同时具有A>I和C>U编辑的双重活性,脱靶现象严重。
为了避免上述突变酶的缺陷,李轩研究组通过半理性设计,改造天然APOBEC3A构建了RNA特异性的C>U的脱氨酶。APOBEC(胞苷脱氨酶)家族催化核酸碱基(C>U)脱氨反应,其成员被用于构建核酸碱基编辑器,是实现核酸非切割精准编辑的重要工具。APOBEC3A是APOBEC家族的重要成员,具有非常活跃的胞苷脱氨酶活性。但因其拥有对DNA和RNA底物的双重催化活性, 有严重的脱靶效应,限制了APOBEC3A在构建核酸精准编辑器中的应用。
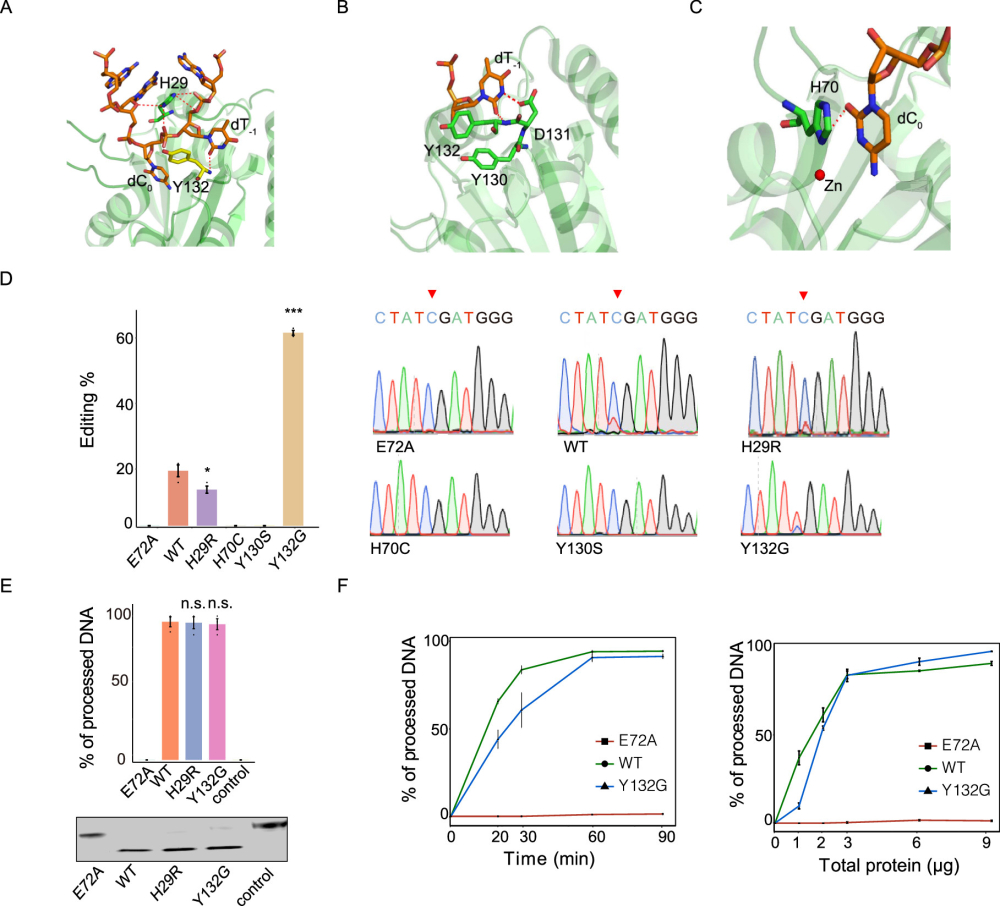
该团队开发了快速检测RNA的C>U编辑报告系统,通过检测23个APOBEC3A突变体,发现APOBEC3A对DNA和RNA的C>U脱氨活性有严格的关联性。但少数突变如N57Q,其DNA和RNA活性发生了相反的变化。通过检查APOBEC3A与DNA底物结合的晶体结构,锁定了其对不同底物识别和催化的区域。该团队在APOBEC3A的Loop-1和Loop-7区域设计了新的突变,验证了H29R和Y132G对RNA和DNA底物的催化活性具有相反的影响。通过设计将Y132G与Loop-1和helix-6区域的突变相结合,获得两个整合突变体:Y132G/K30R和Y132G/G188A/R189A/L190A,成功去除DNA底物的脱氨酶活性同时,保留了对RNA底物的高脱氨酶活性。该工作首次创建了具有RNA特异性胞苷脱氨酶活性的新型A3A变体,为构建RNA特异性C>U精准编辑器提供了新工具。
硕士研究生唐桂月以及博士研究生解冰冉为本文的共同第一作者。该工作获得了国家重点研发计划、国家自然科学基金和中科院先导等项目的支持。
原文链接:https://pubs.acs.org/doi/10.1021/acssynbio.0c00627?ref=pdf

APOBEC3A理性设计改造获得RNA特异编辑酶流程图
根据APOBEC3A晶体结构理性设计改造获得RNA特异的C>U编辑酶