王勇研究组设计开发理性工程提高大肠杆菌中黄芩素产量
2022年3月21日,国际合成生物学领域期刊Biotechnology & Bioengineering在线发表了中国科学院分子植物科学卓越创新中心王勇研究组研究成果“Rational engineering in Escherichia coli for high-titer production of baicalein based on genome-scale target identification”。该研究将系统生物学与合成生物学研究相结合,进一步提升了黄芩素在大肠杆菌中的合成效率。
黄芩素(Baicalein)是唇形科多年生草本中药植物黄芩(Scutellariabaicalensis Georgi)的主要活性成分,具有广泛的药理学活性,其在植物中的天然含量较少。2019年,课题组首次报道了利用大肠杆菌合成黄芩素和野黄芩素(Metab Eng. 2019);后续又报道了通过酶自组装的方法将黄芩素的产量进一步提高(ACS Synth Biol. 2021)。但是该类化合物在微生物底盘中的合成效率仍有待提高。
作为一种生理活性多样的黄酮类化合物,黄芩素的生物合成途径较为复杂,异源产物合成对底盘代谢网络的影响知之甚少。在这项研究中,为了改善大肠杆菌中黄芩素的产率,作者尝试通过比较底盘细胞转录组变化,来理性评估黄芩素合成对底盘细胞全基因组水平的影响,以此寻找影响黄芩素合成效率的靶标基因。通过产物合成不同阶段的RNA-Seq测序分析,发现共有267个基因发生上调,125个基因发生下调。进一步通过基因组尺度的代谢网络靶点理性筛选,发现了13个有益于黄芩素合成的基因,其中8个位于黄芩素合成代谢网络之外,主要涉及嘌呤嘧啶代谢,能量代谢和解毒蛋白,例如下调嘌呤和嘧啶的代谢途径中的pyrB,purC能使黄芩素产量分别提高259 %和123 %。这些有益基因是首次被发现可促进黄芩素的合成。最终结合酶的组装和模块化策略,工程化改造的大肠杆菌可产生367.8 mg/L的黄芩素,这是迄今为止报导的最高产量。这一工作将系统生物学研究与合成生物学研究相结合,进一步提升了黄芩素在大肠杆菌中的合成效率,对指导如何理性设计高效率的天然产物异源合成体系提供了一个成功的例子,也进一步推进了基于合成生物技术的黄芩素的工业化生产。
华东理工大学与中科院分子植物科学卓越创新中心联合培养博士生计东尼为该论文的第一作者,华东理工大学教授任宇红与中科院分子植物科学卓越创新中心王勇研究员为论文的并列通讯作者。该工作获得了国家重点研发计划(2018YFA0900600)、上海市优秀学术带头人计划(20XD1404400)、中科院先导B等项目的支持。
全文链接:https://onlinelibrary.wiley.com/doi/10.1002/bit.28087
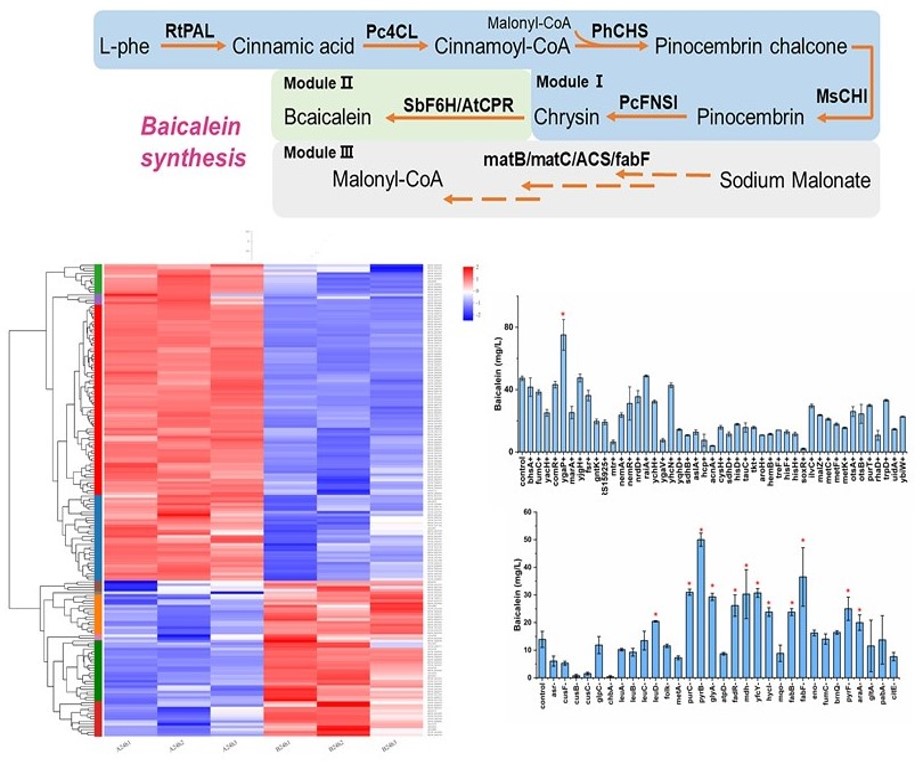
基于基因组规模的目标识别以提高黄芩素的生物合成