王勇研究组在大肠杆菌中实现了多种氧化贝壳杉烷类二萜的高效从头合成
2022年8月12日,国际期刊Metabolic Engineering在线发表了中国科学院分子植物科学卓越创新中心王勇研究组题为“De novo production of versatile oxidized kaurene diterpenes in Escherichia coli”的研究论文,该研究以大肠杆菌为底盘高效地实现了11种不同氧化形式的对映-贝壳杉烷类二萜化合物的从头生物合成。
对映-贝壳杉烷类二萜是一类重要的天然产物,具有多样的化学结构,在植物的生长发育、微生物防御、应对非生物胁迫等生命过程中起到关键作用。此外,此类化合物还具有显著的细胞毒性、抗肿瘤活性、特殊风味口感等理化性质,因此被广泛应用于食品工业和药物开发领域中。在此类化合物的生物合成中,母核骨架的羟基化修饰为进一步发生糖基化、酰基化等提供了支点,是产生终端产物多样性的重要前提。通常,对映-贝壳杉烷母核的C1、C3、C7、C13、C16、C19等位置富于各种氧化修饰。例如C7和C19的羧基化是植物激素赤霉素类合成途径中的关键步骤;C7、C3和C1的氧化取代在唇形科香茶菜属植物的活性二萜中尤为常见;C13的羟基引入对于甜菊糖苷类的合成至关重要,而以C16-羟基对映-贝壳杉烷为前体的化合物则包括具有抗HIV活性的雷公藤福定(tripterifordin)等分子。
目前对于对映-贝壳杉烷母核的氧化修饰主要通过化学合成实现,存在反应步骤冗长,产率低等诸多问题。此外,有机合成亦较难实现具有立体选择性或位点特异性的高效氧化修饰。鉴于上述原因,在本研究中,作者开发了一系列大肠杆菌工程菌株,以特异性的细胞色素P450氧化酶和萜类合酶为介导,实现了多种对映-贝壳杉烷类氧化中间体的从头生物合成。研究者首先通过菌株筛选和前体强化,确定了增强甲羟戊酸(MVA)途径的K系大肠杆菌为最合适的合成宿主。进一步,通过筛选不同物种来源的贝壳杉烯氧化酶(KO)并以N端融合助溶标签的方式,成功提升了关键中间体对映-贝壳杉烯酸(KA)的产量(~250 mg/L)。以甜菊醇(SV)为目标,研究者组合了N端改造、密码子优化、拷贝数和表达强度调节等多种的策略对贝壳杉烯酸13位羟化酶(KA13H)进行了优化,选择拟南芥来源的AtCYP714A2为最佳的KA13H,在引入细胞色素b5(甜叶悬钩子来源的RsCYB5)改善电子传递并抑制蛋白降解的帮助下,大幅提升了SV在摇瓶中的合成效率,产量达到521 mg/L。为了进一步提高KA至SV的羟基化转化率,作者利用AlphaFold预测了AtCYP714A2的结构并将其与二萜底物进行了分子对接模拟。根据蛋白-底物复合物对接模型,将底物结合口袋中潜在的十余种关键氨基酸残基进行定点突变后发现,突变体I403L能够通过解除底物抑制、增强底物结合亲和力等方式提升KA的13位羟基化效率。相比于野生型AtCYP714A2,突变体I403L的KA转化率由71%提升至87%。最终,组合最优的KO和KA13H突变体后,研究者在5 L发酵罐中实现了克级规模的甜菊醇的从头生物合成,产量达到1.07 g/L。
以此为基础,将上述优化策略运用于不同的氧化修饰酶后,作者还成功地获得了多种C3、C7、C16、C19单氧化或双氧化的对映-贝壳杉烷类二萜分子。利用水稻来源的OsCYP76M家族氧化酶、OsCYP99A3,链霉菌来源的双加氧酶PtmO6,小立碗藓来源的双功能萜类合酶PpCPS/KS和多种不同来源的KO的组合生物合成策略,研究者在大肠杆菌中合成了7β-羟基对映-贝壳杉烯,3α-羟基对映-贝壳杉烯,7β-羟基对映-贝壳杉烯-19-酸,3α-羟基对映-贝壳杉烯-19-酸,16α-羟基对映-贝壳杉烷,16α,19-二羟基对映-贝壳杉烷,16α-羟基对映-贝壳杉烷-19-酸等分子,摇瓶中的产量分别达到20~600 mg/L。
本研究建立了高效合成氧化对映-贝壳杉烷类二萜分子的原核生物合成体系,以简单碳源(甘油)为起始,在不添加复杂前体物质的情况下实现了多种贝壳杉烷类二萜氧化中间体的从头生物合成,不仅为进一步工业化大规模制造复杂的二萜分子提供了基础,也为筛选和鉴定未知的贝壳杉烷类二萜氧化酶提供了一个可靠的平台。
中国科学院分子植物科学卓越创新中心王勇研究员为本文的通讯作者。天然产物合成生物学研究组副研究员孙雨伟、博士生陈卓为该论文并列第一作者。该研究得到国家重点研发计划、国家自然科学基金、上海市优秀学术带头人计划、中国科学院先导B及中科院青促会的资助。
论文链接:https://www.sciencedirect.com/science/article/pii/S1096717622000969
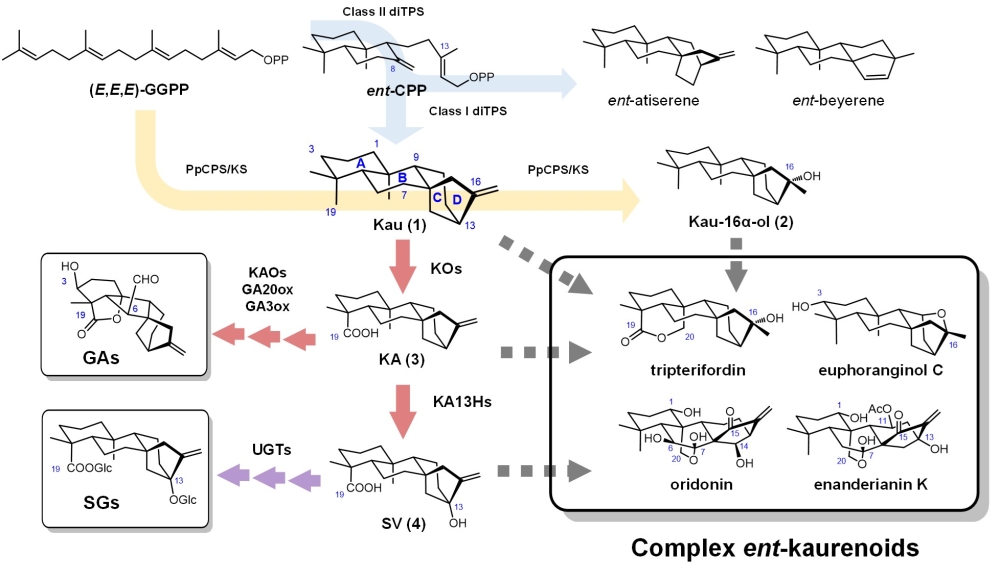
图. 氧化贝壳杉烷二萜的生物合成