万里研究组合作揭示植物免疫信号和细菌免疫通路交叉及相互激活的机制
Toll/Interleukin-1 Receptor (TIR) 结构域蛋白在原核生物和真核生物中普遍存在,主要功能是介导免疫反应和细胞死亡。植物TIR免疫受体作为NAD+裂解酶发挥功能,产生信号小分子激活下游的脂肪酶类似蛋白EDS1而引起免疫和细胞死亡。除了激活EDS1的信号小分子,植物TIR降解NAD+还生成cADPR的同分异构体。目前结构已解析的cADPR同分异构体包括2’cADPR和3‘cADPR,但植物TIR具体产生何种cADPR同分异构体及其功能也还不明确。
细菌对抗病毒的Thoeris免疫系统由两个蛋白构成,ThsB和ThsA,其中ThsB含有TIR结构域。噬菌体侵染激活细菌ThsB较弱的NAD+降解酶活性,产生未知的信号分子激活下游ThsA的高NAD+降解酶活性,并导致胞内NAD+耗竭和细胞死亡。ThsB较弱的NAD+降解酶活性只有在被噬菌体激活后才会体现,且纯化的ThsB蛋白在体外检测不到酶活。已知植物Bd-TIR也能激活ThsA,但ThsB 和Bd激活ThsA的信号分子未知。
2023年3月17日,国际学术期刊Science Advances在线发表了中国科学院分子植物科学卓越创新中心万里研究组和美国科罗拉多州立大学Marc Nishimura团队的最新合作研究成果,题为“Plant and prokaryotic TIR domains generate distinct cyclic ADPR NADase products”。该论文首先成功构建了在体外具有酶活的ThsB自激活突变体ThsB-auto, 并详细研究了细菌ThsB-auto和植物Bd降解NAD+的产物。结果发现ThsB-Auto产生两种cADPR异构体,一种是未知的,另外一种是3'cADPR。Bd同时产生了2'cADPR(主要产物)和3'cADPR(次要产物)。
进一步本研究确定了3’cADPR应该就是Thoeris免疫系统的信号分子,完善了人们对细菌免疫系统Theoeris工作机制的认知,并对植物 Bd-TIR 跨界激活细菌Thoeris 免疫系统做了解释。此外本研究进一步加深了人们对 TIR 作为NAD+降解酶产生的信号小分子的认知,同时也开启了cADPR异构体在植物体内的功能研究。
美国科罗拉多州立大学的博士后Adam Bayless与万里研究组的博士生陈思思为论文的共同第一作者,万里研究员和美国科罗拉多州立大学Marc Nishimura副教授为共同通讯作者。分子植物科学卓越创新中心质谱平台的徐晓燕博士参与了该研究的相关工作。该项研究得到中科院先导项目和国家自然科学基金的资助。
论文链接:https://www.science.org/doi/10.1126/sciadv.ade8487
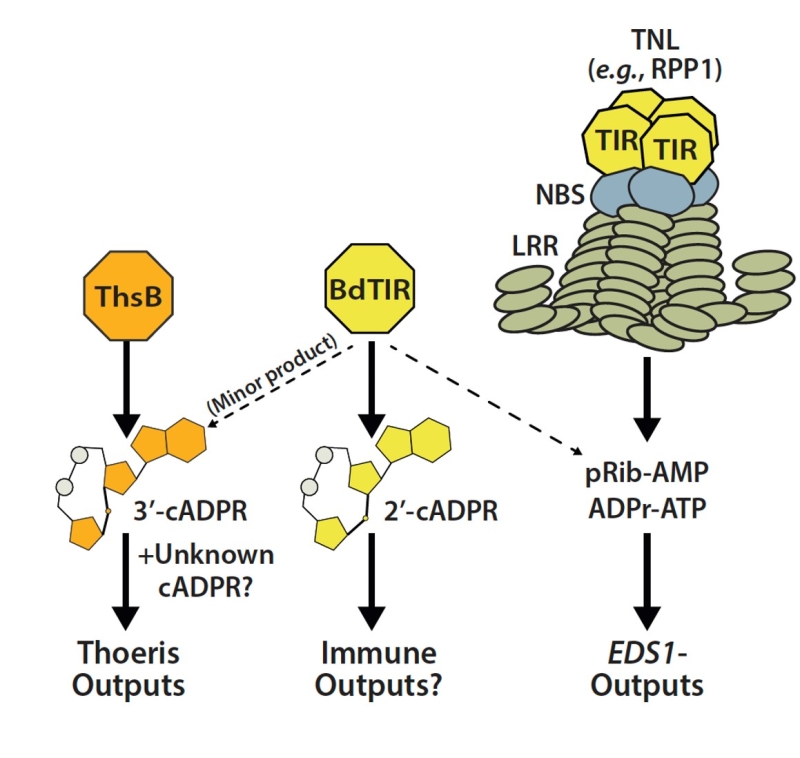
Model of Thoeris and EDS1-pathway stimulation by signals from plant and prokaryotic TIRs