张鹏研究组合作揭示拟南芥NO3-转运蛋白CLCa的调控机制
2023年8月12日,国际学术期刊Nature Communications在线发表了中国科学院分子植物科学卓越创新中心张鹏研究组合作完成的题为“Molecular mechanism underlying regulation of Arabidopsis CLCa transporter by nucleotides and phospholipids”的研究成果,揭示了核苷酸和磷脂调控拟南芥硝酸根转运蛋白CLCa的分子机制。
CLC(Cl- channel)蛋白普遍存在于生命体中。在哺乳动物中,CLC蛋白分为定位在细胞质膜上的Cl-通道,以及定位在内膜系统的Cl-/H+逆向转运蛋白。在模式植物拟南芥(Arabidopsis thaliana,At)及其他植物中,CLC蛋白(CLCa-g)均定位于内膜系统。其中,CLCa转运蛋白定位于液泡膜,负责将胞质中过多的NO3-转运进入液泡。近年来的研究发现,真核生物CLC的活性受到核苷酸和磷脂的调控。ATP和AMP可以差异性调控AtCLCa的转运活性,从而根据光合效率调控叶肉细胞中的NO3-进入液泡; PI(3,5)P2则可以抑制AtCLCa的转运活性,从而调控ABA诱导的保卫细胞液泡酸化和气孔关闭。然而,人们对核苷酸和磷脂调控CLC转运活性的分子机制并不清楚。
本研究以拟南芥CLCa蛋白为研究对象,通过异源表达并纯化CLCa蛋白,将其重组为纳米磷脂盘(nanodiscs)以模拟其在生物膜中的天然状态,并分别解析了CLCa结合底物NO3-和Cl-的单颗粒冷冻电镜三维结构。CLCa形成同源二聚体,结合NO3-的CLCa结构的阴离子转运通道处于开放状态,而结合Cl-的CLCa结构的孔道在膜两侧都处于关闭状态。两个CLCa结构都结合了ATP和PI(4,5)P2分子。结构和电生理分析揭示了ATP的结合会稳定一个之前未被发现的N端β发夹结构,使其堵塞阴离子转运通道,因此抑制了CLCa的转运活性。而AMP由于缺乏稳定β发夹结构所需的β/γ磷酸基团而失去抑制能力,因此可以与ATP竞争性结合CLCa从而释放其转运活性。该工作很好地解释了CLCa如何通过感知不同光合效率下叶肉细胞的能量状态(ATP/AMP比例)来调节NO3-向液泡中的转运,从而维持碳氮平衡(图1a)。PI(4,5)P2或PI(3,5)P2分子可以结合在CLCa的二聚体交界面上,其肌醇头部占据了附近的质子转运通道的细胞质侧出口,可能因此抑制了CLCa的转运活性。这有助于理解生理状况下PI(3,5)P2如何通过抑制CLCa的转运活性,从而促进ABA诱导的保卫细胞液泡酸化和气孔关闭(图1b)。序列分析显示核苷酸和磷脂的调控机制在植物液泡膜定位的CLC蛋白中可能都是保守的。
本研究揭示了核苷酸和磷脂在特定生理场景下调控拟南芥CLCa活性的分子机制,为未来改造植物CLC蛋白进而调控碳氮平衡以及提高水分利用效率奠定了重要的分子基础。此外,研究提示类似的机制可能也存在于其他真核生物CLC蛋白中。
中国科学院分子植物科学卓越创新中心张鹏研究组杨朝博士、张雪博士以及中国科学院脑科学与智能技术卓越创新中心蔡时青研究组博士生叶士伟为论文的第一作者,张鹏研究员、蔡时青研究员以及复旦大学陈振国研究员为共同通讯作者。冷冻电镜数据收集和样品分析得到了复旦大学、中国科学院生物与化学交叉研究中心和中国科学院分子植物科学卓越创新中心公共技术服务中心的支持和帮助。研究得到国家自然科学基金和中科院先导项目的资助。
论文链接:https://www.nature.com/articles/s41467-023-40624-z
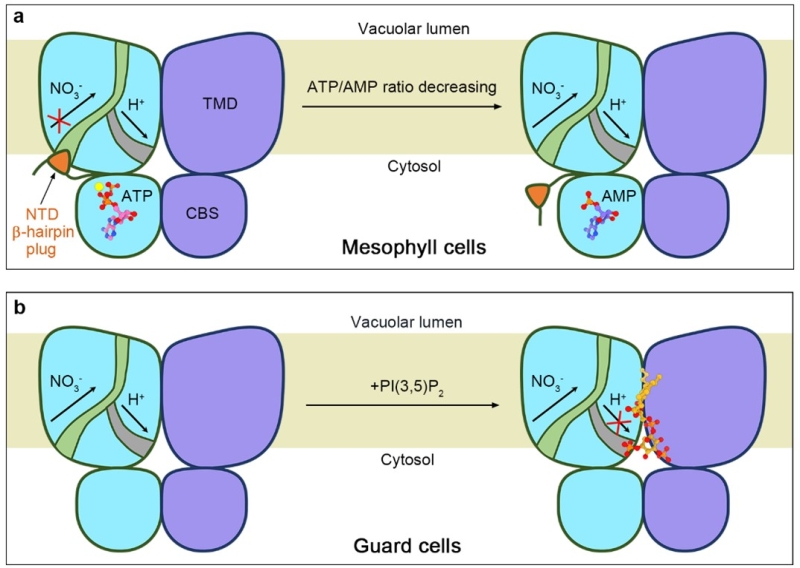
图1.核苷酸和磷脂调控拟南芥不同生理场景CLCa活性的分子机制模型。