王四宝研究组揭示群体感应激活的苯丙氨酸代谢调控外膜囊泡生成以促进蚊虫肠道共生菌定殖抗疟原虫感染的分子机制
2023年9月21日,中国科学院分子植物科学卓越创新中心王四宝团队在国际著名学术期刊Cell Host & Microbe在线发表了题为"Quorum sensing-activated phenylalanine metabolism drives OMV biogenesis to enhance mosquito commensal colonization resistance to Plasmodium"的研究成果。该研究揭示了肠道共生菌通过群体感应系统激活苯丙氨酸代谢调控外膜囊泡(Outer membrane vesicle, OMV)生成的分子机制,并发现共生菌通过释放大量OMVs促进生物被膜样聚集体(biofilm-like aggregate)的形成,进而促进共生菌在蚊虫肠道定殖和对抗疟原虫感染的机制,为提高共生菌阻断蚊媒病原感染和传播提供了新途径。
肠道微生物与宿主共同进化形成稳定的共生关系,共生菌的定殖和稳态在宿主健康和抵御外来病原的入侵中起着至关重要的作用。有关肠道微生物的定植和稳态调控研究主要是从宿主免疫调节的角度进行的。尽管目前对肠道致病菌在肠道内定植的机制进行了广泛研究,但对于肠道共生菌如何适应和定植肠道的机制了解甚少。
蚊虫是疟疾、登革热等多种疾病的传播媒介,对全球公共卫生和人类健康造成了沉重负担。这些病原体随着蚊虫吸血被摄入到肠道内,而肠道微生物在维护蚊虫的肠道屏障和抵御病原体感染中扮演着重要的角色。利用蚊虫肠道共生菌来抑制疟原虫感染传播的共生菌阻断控制策略,被认为是一种有前景的疟疾防控新方法。然而,蚊虫肠道共生菌的功能发挥取决于其在肠道内的定殖能力。因此,深入了解肠道共生菌定植的机制将为提高共生菌阻断控制策略的防控效果提供新的思路。
蚊虫在羽化发育为成蚊后,雌蚊依靠吸血来产卵繁殖后代。在血液消化过程中释放大量蛋白质、脂类、含铁血红素等物质,造就了高活性氧的肠道微环境,对肠道微生物产生氧化胁迫。面对血液消化产生的氧化应激,非共生菌被排出肠道,共生菌则演化出适应吸血后的肠道微环境并实现稳定定殖。然而,共生菌的肠道定殖机制有待阐明。作为蚊虫肠道核心共生菌,沙雷氏菌可定殖于主要病媒蚊虫肠道,并显著影响蚊媒病原体感染和传播,在蚊媒疾病防控中具有重要的应用价值。王四宝团队前期研究发现了一株具有天然抗疟活性的按蚊肠道共生菌——解脲沙雷氏菌(Serratia ureilytica)Su_YN1,揭示了其通过分泌OMV递送抗疟脂肪酶杀灭疟原虫(Nature Microbiology, 2021;Nature Communications, 2023)。该共生菌在蚊虫肠道中具有显著的定殖优势,且可通过水平和垂直传播等方式在蚊群中快速散播来驱动疟蚊抑制疟原虫感染传播。
为了破译蚊虫肠道共生菌定殖的奥秘,本研究以天然抗疟共生沙雷氏菌Su_YN1为模型,对驱动Su_YN1肠道定殖的机制进行了深入解析。研究发现,蚊虫吸食的血液促进Su_YN1快速增殖,并在吸血蚊虫肠道中形成生物被膜样聚集体,帮助共生菌适应肠道环境以实现定殖(图1A)。进一步观测表明,这些生物被膜样聚集体含有大量的OMV(图1B),且OMV促进生物被膜样聚集体的形成(图1C)。在机制方面,Su_YN1通过快速增殖激活了密度依赖的AHL型群体感应系统(Quorum sensing, QS)。群体感应是细胞群体通过一些化学信号进行交流的过程,用于监测自身群体密度从而协调群体行为,以完成一些重要的生理学功能。该系统由QS信号分子合成酶SueI和QS受体蛋白SueR组成(图1D)。一旦Su_YN1群感系统被激活,SueI合成酶便负责产生大量含有六个碳烃链的N-己酰基-L-高丝氨酸内酯(C6-HSL)群感信号分子(图1E)。比较转录组分析表明,添加C6-HSL或敲除SueR后,导致一个苯丙氨酸代谢基因簇上调表达(图1F)。分析发现,在缺乏C6-HSL的条件下,SueR结合在苯丙氨酸代谢基因簇的启动子上,进而抑制基因的表达。然而,群感激活产生的C6-HSL可以直接与SueR结合,解除SueR的抑制作用,从而激活了苯丙氨酸代谢基因簇(图1G)。当敲除苯丙氨酸代谢基因簇相关基因后,导致OMV产量和聚集体形成显著降低,表明苯丙氨酸代谢在调控OMV的生成中发挥了关键作用。进一步研究发现,这一苯丙氨酸代谢基因簇参与了将苯丙氨酸代谢转化为乙酰辅酶A的过程。乙酰辅酶A不仅是脂肪酸链延长的主要底物,还能通过三羧酸循环产生ATP。因此,这一代谢途径在底物和能量供给两个层面驱动了OMV的生成(图1H)。大量产生的OMV有助于促进共生菌Su_YN1在蚊子肠道内形成生物被膜样聚集体,进而增强了共生菌在蚊虫肠道中的定殖。
重要的是,按蚊体表接触C6-HSL后,能够显著提高Su_YN1在蚊虫肠道中的定殖丰度,从而显著提高其抗疟效果(图1I)。C6-HSL作为一种环境友好的分子,为增强蚊虫共生菌在肠道中的定殖和抗疟效能提供了新的途径。此外,研究还发现其它共生菌,如沙雷氏菌AS1和成团泛菌,也能在吸血蚊虫的肠道内形成聚集体。这一新发现表明,生物被膜样聚集体的形成可能是肠道细菌适应性定殖吸血节肢动物肠道环境的普遍机制。该研究首次揭示了苯丙氨酸代谢直接受到群体感应系统的调控,并参与调控OMV生成的新机制,深化了对肠道菌胞外囊泡的代谢调控机制及其介导肠道菌适应性定殖蚊虫肠道策略的理解(图2),为提高共生菌阻断疟原虫感染和传播的效能提供了新的思路。
中国科学院分子植物科学卓越创新中心已毕业博士研究生蒋永茂和高涵副研究员为论文的共同第一作者,博士后王官栋、博士研究生汪丽华和胡文倩也参与了相关工作,王四宝研究员为论文通讯作者。该工作还得到了上海交通大学何亚文教授的宝贵建议。OMV分析和电镜观察得到了所级公共技术服务中心、Malvern Panalytical和Neoland Biosciences公司的支持和帮助。该研究得到了国家自然科学基金委、盖茨基金会、中国科学院、国家重点研发计划、中科院青年促进会和上海市科委等项目资助。
文章链接:https://doi.org/10.1016/j.chom.2023.08.017
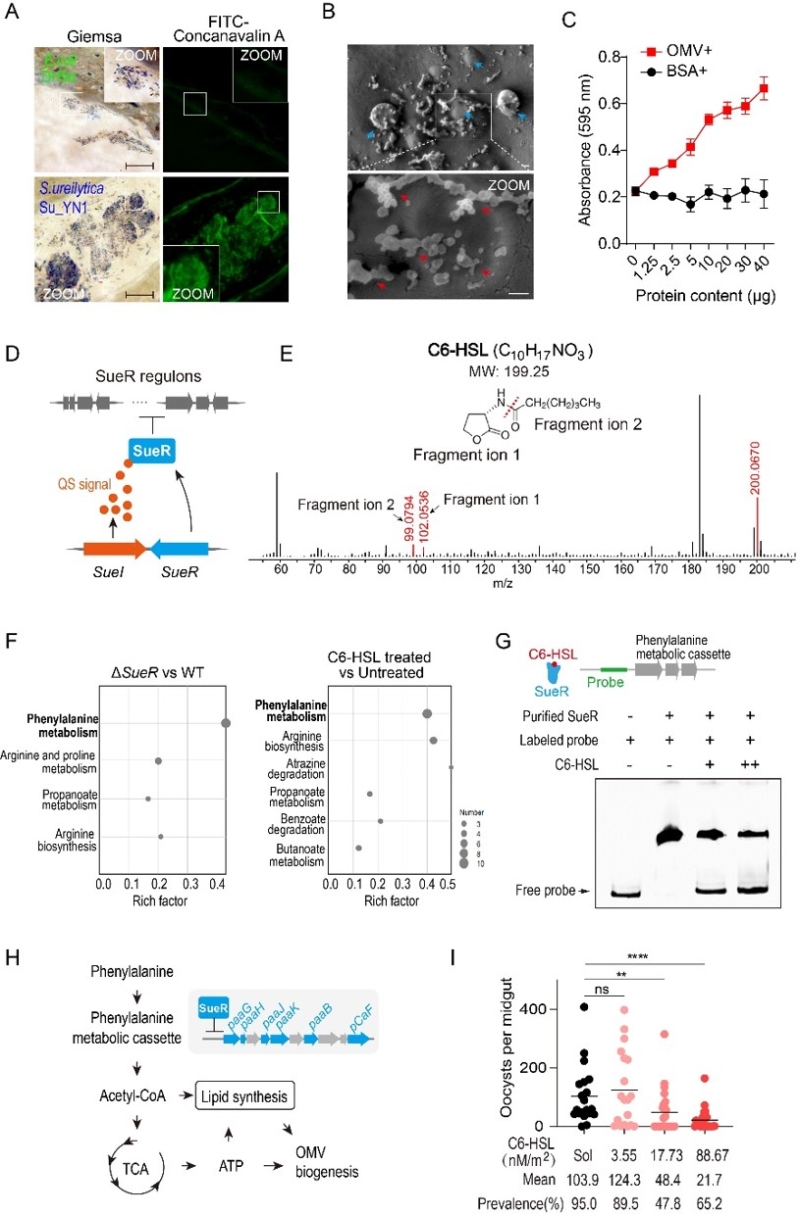
图1. 群体感应通过苯丙氨酸代谢调控外膜囊泡生成并促进共生菌在蚊虫肠道定殖。(A)沙雷氏菌Su_YN1在吸血蚊虫肠道中形成类生物膜样聚集体;(B)Su_YN1类生物膜样聚集体含有大量OMV;(C)OMV促进生物膜样聚集体的形成;(D)沙雷氏菌Su_YN1群体感应系统构成图;(E)质谱鉴定C6-HSL群感信号分子结构;(F)转录组分析表明,该群感系统通过C6-HSL控制着一个苯丙氨酸代谢基因簇;(G)C6-HSL分子直接结合SueR并激活了苯丙氨酸代谢基因簇;(H)苯丙氨酸代谢转化为乙酰辅酶A以及进一步产生ATP,从而驱动OMV的生物发生;(E)Su_YN1在吸血蚊虫肠道中形成类生物膜样聚集体;(I)按蚊体表接触C6-HSL提高Su_YN1的肠道定殖丰度和抗疟效能。
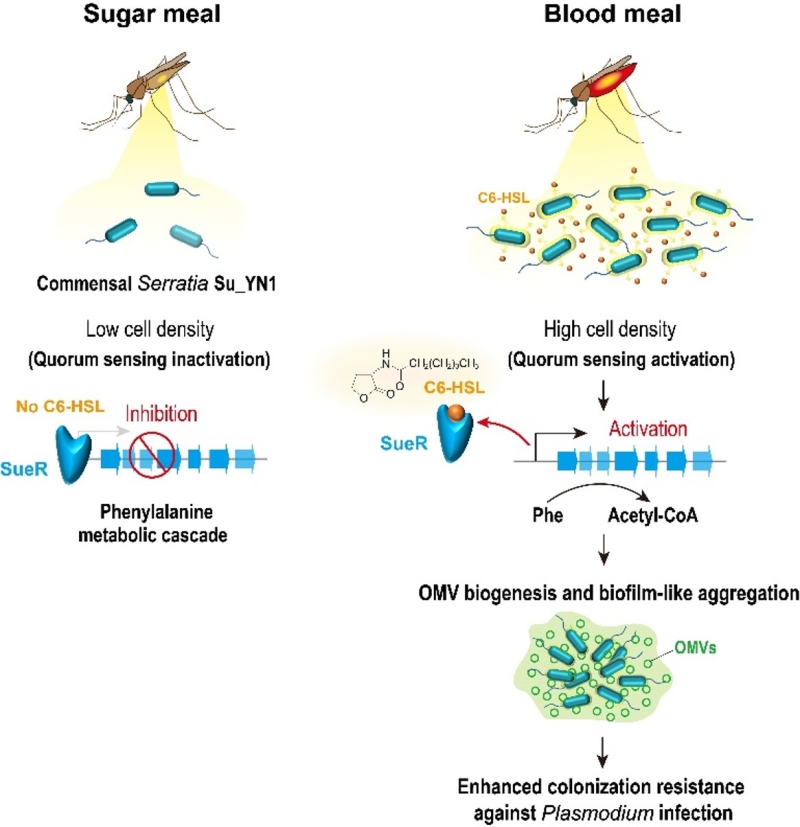
图2. OMV生成及其介导蚊虫肠道共生菌定殖抗疟原虫感染的调控机制示意图