杨琛研究组揭示了细菌中多胺合成的新途径
2023年10月25日,国际学术期刊Science Advances在线发表了中国科学院分子植物科学卓越创新中心杨琛研究组完成的题为“A bacterial spermidine biosynthetic pathway via carboxyaminopropylagmatine”的研究论文。该研究揭示了一条新的亚精胺合成途径——CAPA途径,且该途径广泛分布于变形菌、厚壁菌和拟杆菌等多种细菌中。
多胺即含有两个及以上氨基的正电荷有机小分子化合物,几乎存在于所有细胞生物中,并在多种生理过程中发挥重要作用,包括基因调控、细胞增殖和分化以及对各种胁迫的适应等。亚精胺作为最广泛分布的三胺,存在于所有真核生物、古菌以及大多数细菌中,被认为是生命始祖(LUCA)中存在的原始代谢物之一。目前已知存在两条主要的亚精胺合成途径,其反应本质都是对腐胺的氨丙基化,其中由腺苷甲硫氨酸脱羧酶与亚精胺合酶介导的经典合成途径分布最广。然而,许多细菌的基因组并不编码亚精胺合酶,其亚精胺合成途径仍不清楚。
作者利用动态代谢组学、稳定同位素示踪以及遗传和生化表征,发现并解析了模式蓝细菌集胞藻Synechocystis sp. PCC 6803中的亚精胺合成途径——CAPA途径(图1):首先,胍丁胺和天冬氨酸半醛通过还原缩合生成一种此前未知的多胺,羧氨丙基胍丁胺(CAPA),该反应由NADPH依赖的CAPA脱氢酶催化;随后,CAPA脱羧酶催化CAPA发生脱羧反应生成氨丙基胍丁胺(APA);最后,APA经尿素水解酶催化水解产生亚精胺。因此,CAPA途径以胍丁胺而非腐胺为直接底物,并通过与天冬氨酸半醛缩合实现碳链的延长。与经典的由亚精胺合酶介导的合成途径相比,CAPA途径所需能量更少,且避免了复杂的副产物回用过程。
基因组学与宏基因组学分析表明,CAPA途径基因广泛分布于包括蓝细菌门、变形菌门、厚壁菌门和拟杆菌门等15个细菌门类中(图2),这些细菌分布于各类生态系统包括动物消化道、土壤、海洋、淡水以及沉积物等。CAPA途径的发现,为人工调控细菌中多胺介导的生理功能提供理论基础,为多胺及其衍生物的生物合成提供新的策略,对理解初级代谢的进化与多样性具有重要意义。
中国科学院分子植物科学卓越创新中心杨琛研究组博士研究生席华超为论文的第一作者,助理研究员聂小群和杨琛研究员为通讯作者。该研究得到了江南大学蔡宇杰教授和梁鑫鑫博士,以及中国科学院水生生物研究所徐旭东研究员的帮助;中心公共质谱与核磁平台的徐晓燕、王姗姗、胡文利、张玉路和蓝文贤对化合物分析提供了帮助;方子君和齐子艾对离子质谱检测提供了帮助;杨琛研究组的高方、李虎和周海燕也参与了研究工作。该研究得到国家重点研发计划、国家自然科学基金和中国科学院先导项目的资助。
文章链接:http://www.science.org/doi/10.1126/sciadv.adj9075
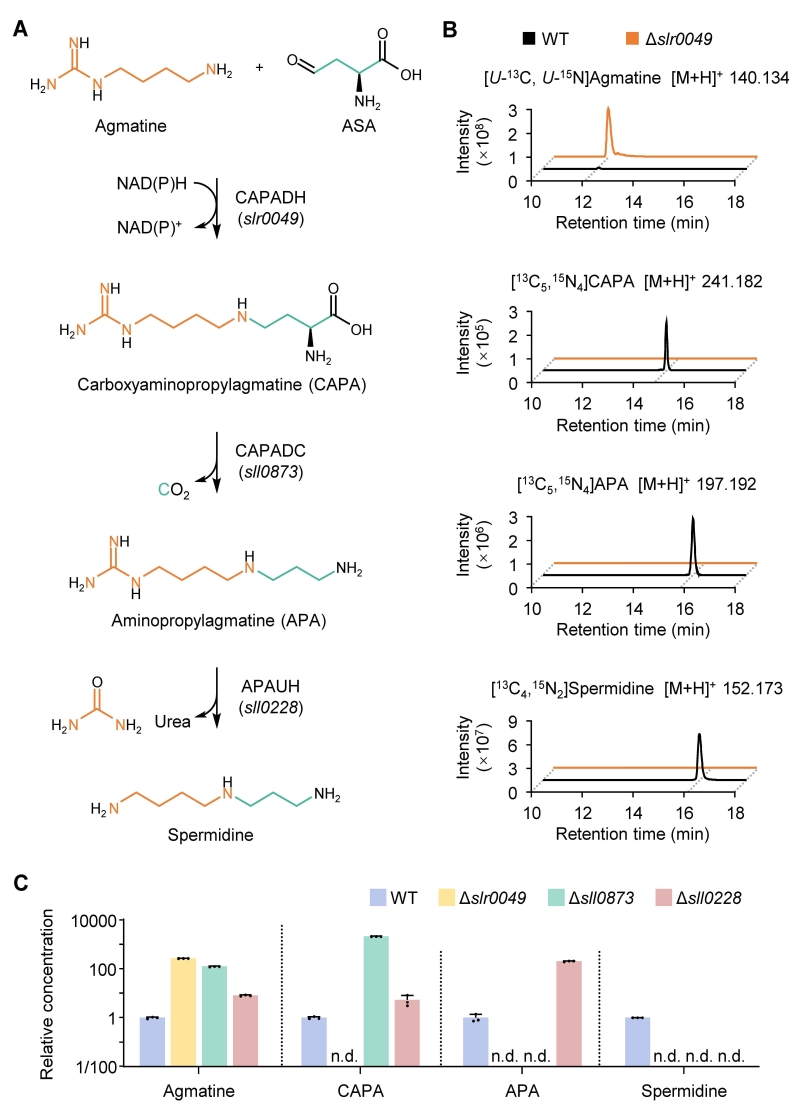
图1. CAPA途径的鉴定
(A) CAPA途径;(B) 稳定同位素示踪;(C) CAPA途径基因突变体的中间代谢物浓度。
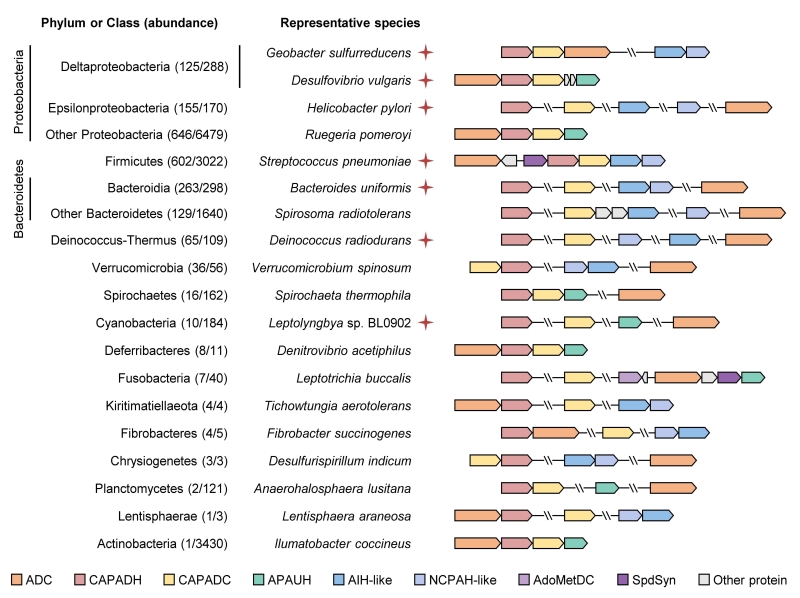
图2. CAPA途径在细菌中广泛分布