王永飞研究组在Ca2+依赖性ABA信号通路解析方面取得研究进展
气孔是由一对保卫细胞环绕而成的表皮特化结构,主要分布在植物叶子表面,是植物与环境进行物质和信息交换的重要渠道和门户。植物通过气孔吸收CO2用于光合作用、释放光合作用产生的氧气和蒸腾失水。植物感知干旱胁迫等环境信号后,通过调控气孔的开度对环境做出反应,以平衡植物耐逆反应和生长发育。早期的研究已经表明,Ca2+作为第二信使参与ABA信号的传递和气孔运动的调控,提示气孔保卫细胞中存在一条Ca2+依赖性的ABA信号通路。但科学家们迄今对该信号通路所致甚少。中国科学院分子植物科学卓越创新中心的王永飞研究组不久前鉴定出了一类ABA激活的拟南芥气孔保卫细胞质膜Ca2+通道,其主效组分为四个CNGC家族成员,即CNGC5、CNGC6、CNGC9和CNGC12(简称为CNGC5/6/9/12),ABA通过激活CNGC5/6/9/12产生胞质Ca2+信号,从而诱导气孔关闭(Tan, and Yang et al., Plant Cell 2023)。但ABA激活该气孔保卫细胞质膜Ca2+通道的分子机理还不清楚。
3月6日,王永飞研究组在国际权威期刊The Plant Cell上发表了题为“OPEN STOMATA 1 phosphorylates CYCLC NUCLEOTIDE-GATED CHANNELs to trigger Ca2+ signaling for ABA-induced stomatal closure in Arabidopsis”的研究论文,报道了最新的研究结果。该论文在已有研究基础上,通过电生理筛选,鉴定出了CNGC5/6/9/12的直接上游蛋白激酶类正调控因子OST1。研究人员通过多种技术手段发现,OST1与CNGC5/6/9/12直接蛋白互作,且其靶点区域为CNGC5/6/9/12的N自由端。研究人员进一步通过蛋白质谱和体外蛋白磷酸化等技术鉴定出了OST1磷酸化CNGC5/6/9/12的氨基酸位点,其为CNGC蛋白N端的一个保守的丝氨酸位点。研究人员进一步通过点突变并结合电生理和胞内Ca2+成像等技术手段证明,该OST1靶点丝氨酸残基的S-to-A点突变显著抑制CNGC5/6/9/12的Ca2+通道活性,而该位点S-to-D点突变则显著激活CNGC5/6/9/12的Ca2+通道活性。随后的一系列植物体内实验结果表明,响应干旱和ABA刺激,植物通过OST1对CNGCs的N端这一保守丝氨酸位点的磷酸化激活CNGCs的Ca2+通道活性,激发胞外Ca2+内流和调控气孔保卫细胞内胞质Ca2+的震荡模式,最终实现对气孔运动的调控。该研究揭示出了一条Ca2+依赖性的ABA信号通路,且发现该信号通路与已知不依赖于Ca2+信号的另一个信号分支之间通过OST1实现偶联,从而形成一个ABA信号网络。该研究深化和拓展了人们对Ca2+信号参与ABA诱导的气孔运动调控分子机理的理解,并将推动植物细胞Ca2+信号研究领域的研究进展。
中国科学院分子植物科学卓越创新中心博士研究生杨阳同学、副研究员谭艳秋博士和博士生王新永为该论文的共同第一作者,王永飞研究员为本论文的通讯作者。王鹏程研究组参与了本研究的部分研究工作。本研究得到了中国科学院先导专项(B类)和国家自然科学基金等项目的资助。
论文链接:https://doi.org/10.1093/plcell/koae073
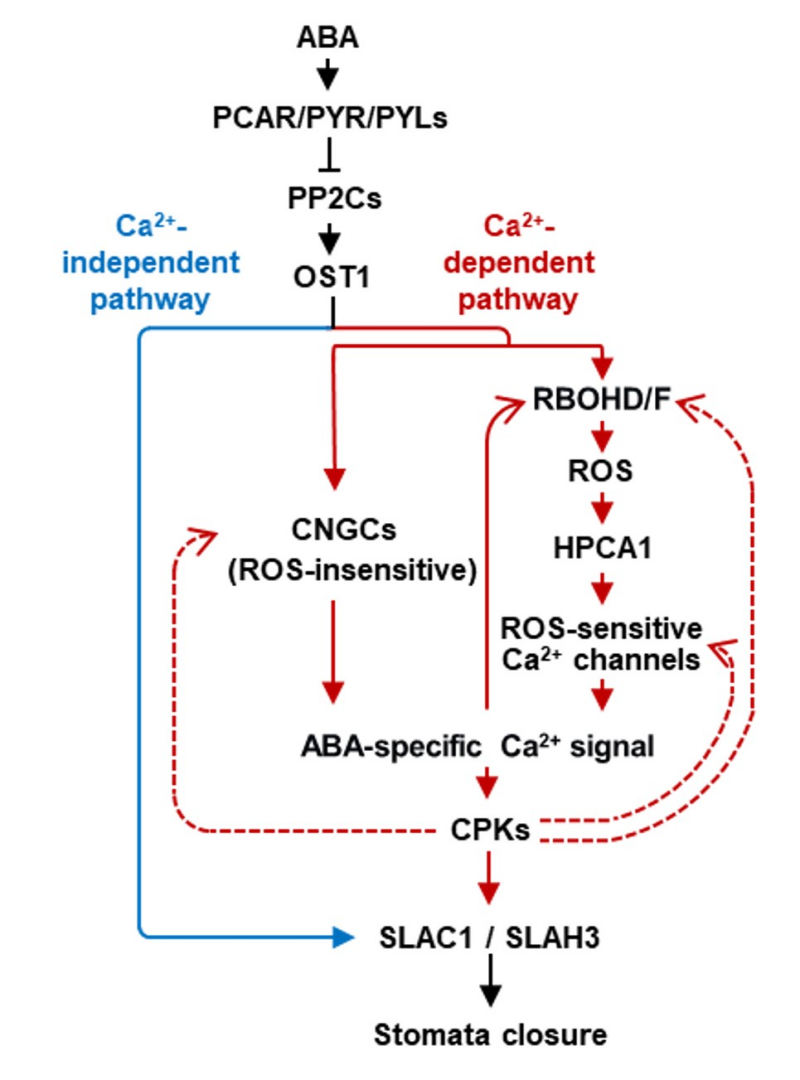
图1. ABA信号通路示意图。蓝色实线示已知不依赖于Ca2+的信号分支。红色线示本研究发现的Ca2+信号依赖性的ABA信号通路,其中虚线部分表示还有待进一步深入研究的可能功能连接。