黄朝锋研究组揭示苹果酸的分泌量决定植物内外解铝毒偏好的新机制
2024年7月26日,国际学术期刊New Phytologist在线发表了中国科学院分子植物科学卓越创新中心黄朝锋研究组题为“Modulation of external and internal aluminum resistance by ALS3-dependent STAR1-mediated promotion of STOP1 degradation”的研究论文。该研究发现了依赖ABC转运蛋白跨膜域ALS3的核苷酸结合域STAR1通过直接介导抗铝毒转录因子STOP1降解从而调控植物内外解铝毒的新机制。
铝毒是酸性土壤上作物生产的主要限制因素,这类土壤占全球陆地面积的30%以上。为了应对铝毒害,植物已经发展出了外部铝排斥和内部铝耐受机制。分泌有机酸,如苹果酸、柠檬酸和草酸,是植物中一种广泛存在的铝排斥机制。在拟南芥中,通过根尖的ALMT1转运蛋白分泌苹果酸,可以促进铝离子的螯合,形成被认为能将铝离子排除在根外的非毒性铝-苹果酸复合物。然而,由ALMT1分泌的苹果酸是否仅用于螯合和排除铝离子,或者是否可以被植物根部重新利用以实现内部铝耐性尚不清楚。
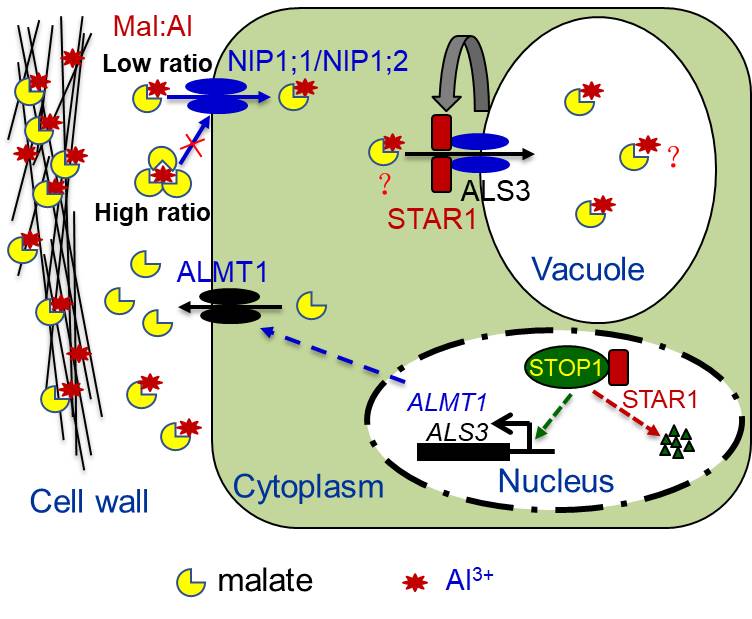
锌指转录因子STOP1是植物中保守的、核心的抗铝毒调节因子,它主要通过激活ALMT1表达实现抗铝毒。由跨膜域ALS3和核苷酸结合域STAR1组成的液泡膜定位的ABC转运蛋白复合物STAR1/ALS3已被报道可以负向调节核定位STOP1蛋白的积累和ALMT1的表达(图1)。然而,STAR1/ALS3复合物控制STOP1蛋白积累的内在分子机制尚未被阐明。
研究组利用受STOP1调控的pALMT1:LUC报告基因系进行正向遗传筛选,鉴定了一个使报告基因和STOP1下游基因表达上升的突变体rae7;基因克隆发现,RAE7编码核苷酸结合域STAR1。之前报道,STAR1与液泡膜定位的跨膜域ALS3互作形成有功能的ABC复合物,可能介导了植物的内部解铝毒。该研究发现STAR1除了定位于液泡膜之外,还存在于细胞核中。因此,作者推测STAR1可能通过直接与STOP1进行互作介导其降解。通过酵母双杂交、split-LUC、BiFC和co-IP实验,证明了STAR1能够与STOP1在细胞核中直接互作,从而促进STOP1的降解。接着该课题组发现,液泡膜定位跨膜域ALS3则是通过调控STAR1蛋白的积累间接调控STOP1蛋白的积累。
F-box蛋白RAE1通过促进STOP1降解负调控植物抗铝毒。然而令人惊奇的是,rae1突变增强而不是缓解star1对铝毒敏感性。进一步生理分析发现,star1rae1双突变体中ALMT1表达升高导致的苹果分泌增强促进了铝的吸收,从而使双突变体对更多的内部铝中毒,表现对铝毒更敏感。通过基因编辑手段对star1 rae1双突变背景的ALMT1启动子进行编辑,发现降低ALMT1表达能够缓解star1 rae1对铝毒的敏感性,该结果进一步佐证了作者的猜想:增强的苹果酸分泌会促进根系对铝的吸收。此外,在star1突变体背景过量表达ALMT1到适中水平也增强植物对铝毒敏感性;但是,如果ALMT1的过表达水平极高则会缓解对铝毒的敏感性。由于苹果酸与铝离子的比例需要达到6-8倍水平才能完全解铝毒,所以作者推测极高水平的苹果分泌可能阻碍铝的吸收,主要起外部铝排斥作用。
进一步研究发现,水孔蛋白家族成员NIP1;1和NIP1;2能够吸收苹果酸-铝复合物,而且偏好吸收低比例复合物。nip1;1 nip1;2的双突变能够极大缓解star1 rae1对铝毒的敏感性。此外,长期低浓度铝毒处理能够显著减少nip1;1 nip1;2双突变体地上部的生长,而对根的影响有限,这说明NIP1;1和NIP1;2在铝胁迫条件下能够帮助植物对苹果酸进行再利用,减少碳损失。
综述所述,该研究揭示了苹果酸的分泌量决定苹果酸-铝复合物是否被排斥在细胞外还是转运进入细胞内。质膜定位的水孔蛋白NIP1;1/NIP1;2与液泡膜定位的STAR1/ALS3 ABC转运蛋白相互协作介导了苹果酸-铝复合物从细胞外至细胞内,最终进入液泡中实现内部解铝毒,并且帮助植物对苹果酸进行再利用,减少碳损失。ALS3依赖的STAR1能够与STOP1直接互作并促进其降解从而调控苹果酸的分泌和植物的内外部解铝毒。
分子植物卓越中心博士毕业生范妮为论文的第一作者,黄朝锋研究员是该论文的通讯作者。黄朝锋研究组毕业博士李鑫波、谢文香、方遒,博士生魏祥和毕业硕士许靖宜也参与了部分研究。该研究受到了中国科学院、国家自然科学基金面上项目和植物分子遗传国家重点实验室等的资助。
原文链接:https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.19985