张鹏与王永飞团队合作揭示植物CNGC钙通道门控与离子选择性的新机制
2025年2月20日,Nature Plants在线发表了中国科学院分子植物科学卓越创新中心张鹏与王永飞团队合作完成的题为Cryo-EM structures of Arabidopsis CNGC1 and CNGC5 reveal molecular mechanisms underlying gating and calcium selectivity的研究论文。该研究通过对模式植物拟南芥CNGC1和CNGC5的结构与功能分析,揭示了植物CNGC通道是一类选择性通透Ca2+、且不受环核苷酸调控的离子通道。
静息状态下,植物细胞质内的Ca2+浓度约为50-150 nM,而在质外体和细胞器(内质网、液泡等)中,Ca2+浓度可达到毫摩级别。这种浓度差使Ca2+可以通过钙通道顺浓度梯度进入细胞内,形成钙信号,调控植物的各种生理活动。植物CNGC通道(Cyclic Nucleotide Gated Channel)由于跟动物体中的CNG通道在序列和功能上相似而得名。然而,与动物CNG通道非选择地介导K+、Na+和Ca2+的通透不同,植物CNGC通道主要介导Ca2+的输入;后者在ABA介导的气孔关闭、花粉管和根毛的发育、免疫反应、菌根共生等生理过程中诱发钙信号的产生。长期以来,植物领域内对“植物CNGC通道的离子选择性和是否受环核苷酸调控”的问题一直存在很大争议。
拟南芥有20种CNGC通道,分属于不同的亚家族。本研究选取来自不同亚家族的CNGC1和CNGC5开展研究。其中CNGC5在调控气孔关闭中发挥作用。利用膜片钳电生理技术,研究人员对CNGC1和CNGC5的活性进行了初步鉴定。发现CNGC1和CNGC5都可以产生超极化激活的内向Ca2+电流,该电流可被典型的钙通道阻滞剂LaCl₃或GdCl₃所抑制;并且二者均无法产生K+/Na+电流(图1a-c)。
进而,研究人员解析了拟南芥CNGC1和CNGC5高分辨率的冷冻电镜三维结构(图1d)。CNGC1和CNGC5结构呈现同源四聚体,由跨膜的电压感知结构域(Voltage Sensor Domain, VSD)、孔道结构域(Pore Domain, PD)以及胞质侧的环核苷酸结合同源结构域(Cyclic Nucleotide Binding Homology Domain, CNBHD)等组成。此外,CNGC1和CNGC5均包含保守的胞外结构域(Extracellular Domain, ECD)。该结构域通过三对保守的二硫键稳定,并将VSD结构域与PD结构域共价偶联在一起,这对于其活性至关重要(图1e)。
CNGC1和CNGC5的PD结构域中选择性过滤器(Selectivity Filter,SF)的结构组成相似,且均包含一个保守的谷氨酰胺,该氨基酸形成SF最狭窄的位点;在CNGC1中可以清晰地观察到所结合的Ca2+和水分子(图2a-c)。据此,研究人员推测Ca2+在通过CNGC1和CNGC5的SF时会经历脱水以及再水合的过程,这很可能是Ca2+选择性的结构基础。将谷氨酰胺突变成谷氨酸或丙氨酸会改变CNGC1和CNGC5的离子选择性,使其非选择地介导K+、Na+和Ca2+的通透,进一步证实了上述观点。
CNGC1和CNGC5的CNBHD结构域缺乏CNBD家族蛋白结合环核苷酸所需的氨基酸和正电荷空腔,这一结构特征决定了它们无法结合环核苷酸,这与电生理实验所测定的结果一致,即cAMP和cGMP均无法调控CNGC1和CNGC5的活性(图2 d-f)。这一结构特征在植物CNGC通道中高度保守,表明植物CNGC通道的活性不受环核苷酸调控。
综上,本研究对领域内长期存在的“植物CNGC通道的离子选择性和是否受环核苷酸调控”问题给出了明确的答案,为生物体中保守存在的CNBD家族通道蛋白提供了新的认知。鉴于CNGC5在ABA诱导的气孔关闭中发挥关键作用,该研究也为气孔改造提供了分子基础。
中国科学院分子植物科学卓越创新中心张鹏研究组博士研究生王建平、王永飞研究组博士研究生杜博雅和张鹏研究组助理研究员张雪博士为该项工作的共同第一作者。张鹏和王永飞为该研究的共同通讯作者。本研究的冷冻电镜数据收集和蛋白样品分析得到了复旦大学和中国科学院分子植物科学卓越创新中心公共技术中心的支持和帮助。本研究得到了国家自然科学基金委、中国科学院及上海市项目的资助。
原文链接:https://www.nature.com/articles/s41477-025-01923-z
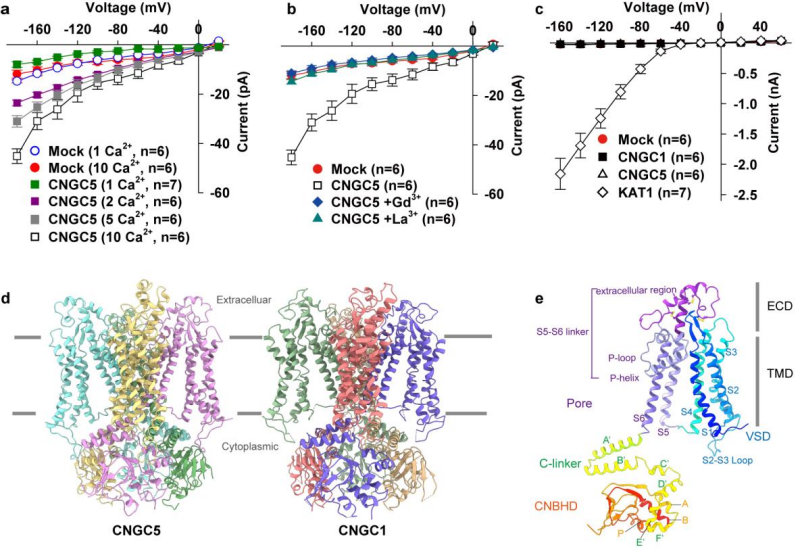
图1. 拟南芥CNGC5/1的活性与三维结构
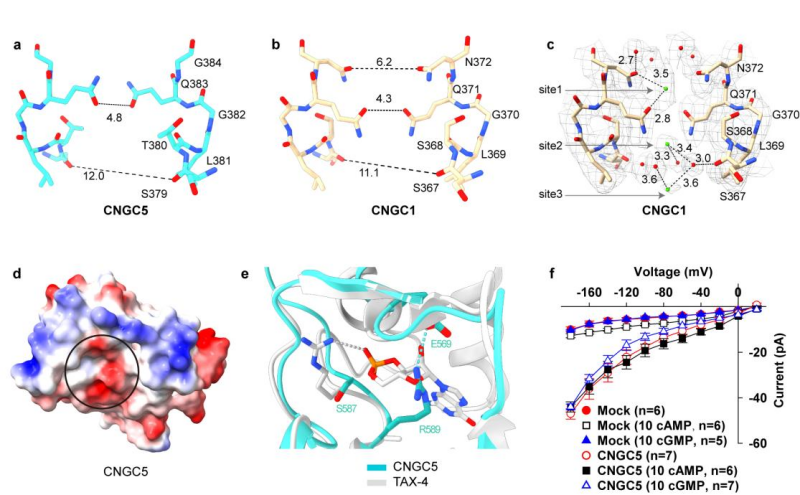
图2. 拟南芥CNGC1和CNGC5的Ca2+选择性和环核苷酸非依赖性