王成树研究组揭示病原真菌抑制昆虫免疫的基因对基因机制
1月3日,Cell Reports期刊在线发表了中国科学院分子植物科学卓越创新中心王成树研究组题为“Suppression of Drosophila antifungal immunity by a parasite effector via blocking GNBP3 and GNBP-like 3, the dual receptors for beta-glucans”的研究论文,揭示了昆虫病原真菌—绿僵菌通过分泌效应蛋白抑制果蝇抗真菌免疫的基因对基因机制。
同植物病原真菌的研究进展相比,昆虫病原真菌抑制寄主免疫抗菌的机理多不清楚。由于昆虫细胞不具有质外体(apoplast)结构,以及昆虫等动物缺少类似植物的核苷酸结合富含亮氨酸重复(NLR)胞内受体,真菌—昆虫,甚至微生物—动物互作的“基因对基因”互作机制仍受质疑,但包括昆虫病原真菌在内的动物病原真菌基因组同样编码有数量不等的潜在效应蛋白基因。
该研究首先针对罗伯茨绿僵菌的40多个潜在效应蛋白基因开展了基因敲除及大蜡螟幼虫的生物测定,发现4个致病毒力相关的基因,针对其中的Tge1(targeting GNBP effector 1)基因开展深入研究发现,该基因保守存在于不同种类的昆虫及植物病原真菌中,有意思的是稻瘟病菌的同源基因能够回补绿僵菌Tge1缺失株的毒力缺陷。以果蝇为对象的靶标筛选及验证表明,Tge1能够结合beta-葡聚糖受体蛋白GNBP3,以及一个功能未知的GNPB-like 3 (GL3)。分析发现,GL3可同样结合真菌细胞成分beta-葡聚糖;不同于监视性(surveillance)的受体GNBP3,GL3为真菌感染时的诱导表达受体,受果蝇抗真菌免疫的Toll信号通路调控。竞争结合实验表明,Tge1可以干扰GNBP3和GL3结合beta-葡聚糖,并且Tge1同GL3的结合能力高于GNBP3。
在果蝇中分别及同时敲除这两个受体基因后,真菌感染结果表明,诱导表达的GL3比GNBP3发挥着更重要的免疫抗菌作用。缺失GL3后,不同抗菌肽基因在果蝇中的表达水平下降更显著。因而,GL3作为共受体,正反馈环路式 (positive feedback loop) 调控Toll信号通路的免疫应答。不同于GNBP3缺失,GL3缺失不会诱导Psh蛋白酶介导的抗菌补偿效应。果蝇转基因表达Tge1后,生物测定及抗菌肽检测表明,Tge1能够显著抑制果蝇表达不同抗菌肽。
该研究成果为真菌—昆虫互作的基因对基因机制提供了有力证据,结合病理学的研究鉴定发现了新型的免疫识别蛋白,揭示了昆虫识别真菌beta-葡聚糖的双受体识别与应答机制。
中国科学院分子植物科学卓越创新中心助理研究员陆梦婷为第一作者,团队成员韦东翔、尚俊梅、李士琴、宋双秀、罗玉娟和唐桂容等参与研究,王成树研究员为通讯作者。该项工作得到了基金委创新研究群体及重点项目等资助。
原文链接:https://doi.org/10.1016/j.celrep.2023.113642
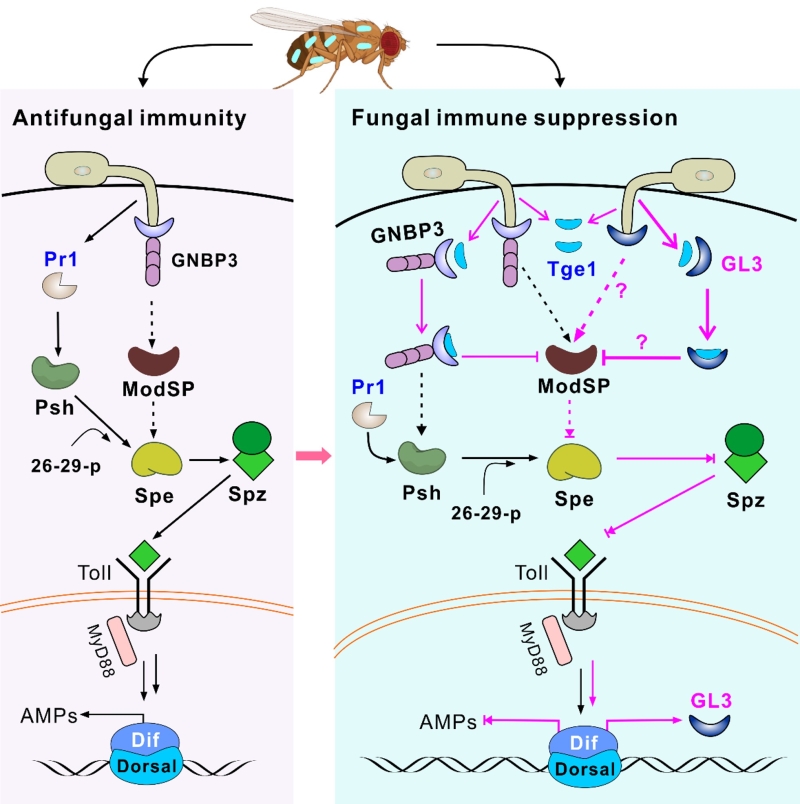
绿僵菌等昆虫病原真菌通过Tge1效应子抑制昆虫免疫识别与应答机制